
【题目】镍粉常用于各种高光泽装饰漆和塑料生产,也常用作催化剂。
I、【镍粉制备】:
工业用电解镍新液(主要含NiSO4、NiCl2)制备碱式碳酸镍晶体xNiCO3·yNi(OH)2·zH2O,并利用其制备镍粉的流程如下: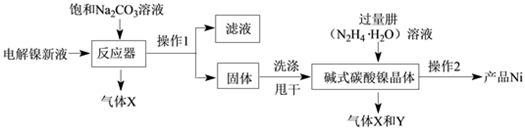
(1)反应器中的一个重要反应为3NiSO4 + 3Na2CO3 + 2H2O = NiCO3·2Ni(OH)2 +3Na2SO4 + 2X,X的化学式为。
(2)物料在反应器中反应时需要控制反应条件。
分析下图,反应器中最适合的温度及pH分别为℃、。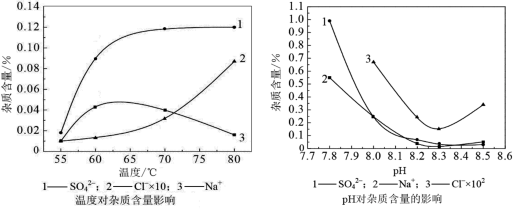
(3)生产中,pH逐渐增加,生成Ni(OH)2含量也相对增加,则生成的碱式碳酸镍晶体中,镍的含量将(填“升高”、“降低”或“不变”)。
(4)操作1的名称是 , 实验室完成此操作,需要的玻璃仪器是烧杯、玻璃棒及 , 其中玻璃棒的作用是。
(5)固体洗涤时,需用纯水洗涤,检验其洗涤干净的试剂是。
(6)气体Y是空气中含量最多的气体,其是(填名称)。
(7)操作2含过滤、水洗、95%酒精浸泡、晾干等操作,其中用95%酒精浸泡的目的是。
(8)II、【测定碱式碳酸镍晶体的组成】:为测定碱式碳酸镍晶体(xNiCO3·yNi(OH)2·zH2O)组成,某小组设计了如下实验方案及装置: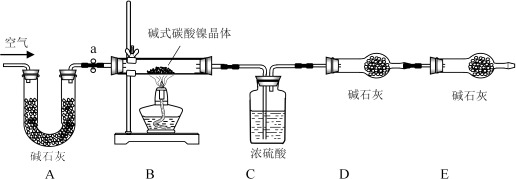
【资料卡片】:
①碱式碳酸镍晶体受热会完全分解生成NiO、CO2及H2O。
②400℃左右,NiO会氧化生成Ni2O3。
③碱石灰是NaOH及CaO的混合物,可以吸收CO2和H2O。
【实验步骤】:
①……;②准确称取3.77g xNiCO3·yNi(OH)2·zH2O放在B装置中,连接仪器;③打开弹簧夹a,鼓入一段时间空气,称量装置C、D的质量;④关闭弹簧夹a,加热装置B至装置C中导管末端无气泡冒出;⑤打开弹簧夹a,……;⑥准确称量装置C、D的质量;⑦根据数据进行计算(相关数据如表)。
装置C / g | 装置D / g | 装置E / g | |
加热前 | 200.00 | 180.00 | 180.00 |
加热后 | 201.08 | 180.44 | 180.00 |
【实验分析及数据处理】:
完善实验步骤中的填空:①;⑤。
(9)计算xNiCO3·yNi(OH)2·zH2O中x:y:z的值。
(10)左侧通空气的目的是、。
(11)实验结束后,称得装置B中残留固体质量为2.33g。请通过计算确定残留固体的组成及各成分的质量(写出计算过程,精确到小数点后两位)。
【答案】
(1)CO2
(2)55,8.3
(3)升高
(4)过滤,漏斗,引流
(5)BaCl2溶液或Ba(NO3)2溶液或Ba(OH) 2溶液
(6)氮气
(7)便于快速晾干
(8)检查装置气密性,缓缓通空气一段时间
(9)1:2:4
(10)排尽装置中原有的CO2和水蒸气,将装置B中的CO2和水蒸气完全排出 【实验反思】:
(11)解:
NiCO3·2Ni(OH)2 ·4H2O ~ | 3NiO ~ | 3Ni ~ | 3O |
377 | 225 | 177 | 48 |
3.77g | 2.25g | 1.77g | 0.48g |
∵ 装置B中残留固体质量为2.33g∴ 残留固体中O元素质量为2.33g – 1.77g = 0.56g,大于0.48g残留固体中Ni、O元素质量比为1.77g:0.56g = 177:56而NiO及Ni2O3中Ni、O元素质量比分别为177:48、177:72,故残留固体为NiO和Ni2O3的混合物。残留固体质量增加2.33g – 2.25g = 0.08g,是和NiO反应的O2质量 设与氧气反应的NiO质量为x 生成的Ni2O3质量为y
4 NiO + | O2 | 2Ni2O3 |
300 | 32 | 332 |
x | 0.08g | y |
x=0.75g y=0.83g剩余NiO质量为2.25g – 0.75g = 1.5g,生成Ni2O3 0.83g。
【解析】I、(1)根据质量守恒定律反应,前后原子的总类和数目不变,
3NiSO4 + 3Na2CO3 + 2H2O = NiCO3·2Ni(OH)2 +3Na2SO4 + 2X,
反应前: | 反应后 |
Ni:3 | Ni:3 |
O:23 | O:17 |
H:4 | H:4 |
C:3 | C:1 |
所以X为:CO2;
(2)反应器中杂质的含量越低越好,所以最适合的温度为55,最适合的pH为8.3;
(3)在NiCO3中镍的含量小于Ni(OH)2中镍的含量,生产中,pH逐渐增加,生成Ni(OH)2含量也相对增加,NiCO3的含量相对减小,则生成的碱式碳酸镍晶体中,镍的含量将升高;
(4)操作1将固体和液体分开,所以操作1为过滤,过滤过程中需要的玻璃仪器是烧杯、玻璃棒及漏斗,玻璃棒起到引流的作用;
(5)洗涤的目的是将碱式碳酸镍晶体表面的硫酸钠溶液等除去,检验其洗涤的是否干净,即检查是否有硫酸根离子,可加入BaCl2溶液或Ba(NO3)2溶液或Ba(OH) 2溶液,观察是否生成不溶于硝酸的沉淀;
(6)空气中含量最多的气体是氮气;
(7)用95%酒精浸泡的目的是使固体表面的水分分散到酒精中,便于固体快速晾干;
II、(8)做有关气体的制取和性质实验前,应先检查装置的气密性,加热后,为了将碱式碳酸镍晶体受热会完全分解生成的CO2及H2O完全被装置C、D吸收,缓缓通一段时间除去水分和二氧化碳的空气;
(9)装置C增加的质量(1.08g)为生成水的质量,装置D增加的质量(0.44g)为生成二氧化碳的质量;所以NiO的质量为3.77g-1.08g-0.44g=2.25g
xNiCO3·yNi(OH)2·zH2O | xCO2↑+ | (y+z)H2O |
75(x+y) | 44x | 18(y+z) |
2.25g | 0.44g | 1.08g |
所以 ![]() ,
, ![]() ,
, ![]() ,
,
解得:x:y:z=1:2:4;
(10)实验开始前左侧通空气的目的是排尽装置中原有的CO2和水蒸气;实验完毕时左侧通空气的目的是将装置B中的CO2和水蒸气完全排出 .
(11)解:
NiCO3·2Ni(OH)2 ·4H2O ~ | 3NiO ~ | 3Ni ~ | 3O |
377 | 225 | 177 | 48 |
3.77g | 2.25g | 1.77g | 0.48g |
∵ 装置B中残留固体质量为2.33g
∴ 残留固体中O元素质量为2.33g – 1.77g = 0.56g ,大于0.48g
残留固体中Ni、O元素质量比为1.77g:0.56g = 177:56
而NiO及Ni2O3中Ni、O元素质量比分别为177:48、177:72,故残留固体为NiO和Ni2O3的混合物;
残留固体质量增加2.33g – 2.25g = 0.08g,是和NiO反应的O2质量
设与氧气反应的NiO质量为x 生成的Ni2O3质量为y
4 NiO + | O2 | 2Ni2O3 |
300 | 32 | 332 |
x | 0.08g | y |
x=0.75g y=0.83g
剩余NiO质量为2.25g – 0.75g = 1.5g,生成Ni2O3 0.83g.
所以答案是:
(1)CO2;
(2)55; 8.3;
(3)升高;
(4)过滤; 漏斗; 引流;
(5)BaCl2溶液或Ba(NO3)2溶液或Ba(OH)2溶液(答AgNO3溶液不给分,因为洗涤液中Cl-含量很低);
(6)氮气(填化学式不给分);
(7)便于快速晾干;
(8)①检查装置气密性; ②缓缓通空气一段时间;
(9)1:2:4;
(10)排尽装置中原有的CO2和水蒸气; 将装置B中的CO2和水蒸气完全排出;
(11)0.83g.
【考点精析】通过灵活运用根据化学反应方程式的计算,掌握各物质间质量比=系数×相对分子质量之比即可以解答此题.


 互动英语系列答案
互动英语系列答案科目:初中化学 来源: 题型:
【题目】下列分类合理的是
A.钙、锌、铁都是人体中的必需微量元素
B.矿泉水、石油、生铁都属于混合物
C.铜、人体和氯化钠都属于导体
D.钳子、开瓶器、镊子都是省力杠杆
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是a、b、c三种固体的溶解度曲线,下列说法不正确的是( )
A.t2℃时a、b的饱和溶液溶质质量分数相等
B.当b中含有少量a时,可以用蒸发结晶的方法提纯b
C.通过降低温度可将c的饱和溶液变为不饱和溶液
D.将t2℃时a、b的饱和溶液降温至t1℃,析出晶体质量a一定大于b
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列做法无助于减轻空气污染的是
A.拆除旧房时边拆边洒水B.禁止用焚烧的方法处理农田中的稻草
C.不在室内,但可在露天场所吸烟D.禁止尾气排放不达标的汽车上路行驶
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】区别下列各组常见物质,括号内选用的方法或试剂正确的是
A.硬水和软水(肥皂水)B.一氧化碳和二氧化碳气体(观察颜色)
C.氢气和氧气(闻气味)D.二氧化碳和氮气(燃着的木条)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】镁是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的,主要步骤是从海水中得到金属镁。下图是从海水中提取镁的简单流程:
(1)为了使 MgCl2转化为沉淀,试剂A可以用 , 加入试剂A过量的目的是 , 验证MgCl2已完全沉淀的方法是;试剂C可选用。
(2)无水MgCl2在熔融状态下通电后会产生Mg和Cl2 , 写出该反应的化学方程式:。
(3)海水本身就是含有MgCl2的溶液,它与通过步骤①、②得到的MgCl2溶液有何不同:。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 分解反应的反应物一定是化合物
B. 由同种分子构成的物质一定是纯净物
C. 核电荷数:S2﹣=S
D. 在原子中质子数不一定等于电子数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com