
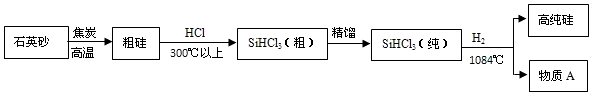
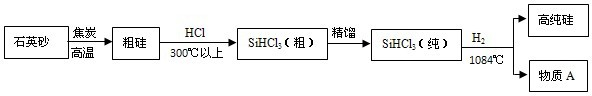
 Si+2R,R的化学式为________;该反应的基本类型是________.
Si+2R,R的化学式为________;该反应的基本类型是________. Si+2CO,是一种单质与一种化合物反应生成另一种单质和另一种化合物的反应,属于置换反应;
Si+2CO,是一种单质与一种化合物反应生成另一种单质和另一种化合物的反应,属于置换反应;

科目:初中化学 来源: 题型:
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源:0109 模拟题 题型:实验题

 Si+2R,R的化学式为______;该反应的基本类型是____________。
Si+2R,R的化学式为______;该反应的基本类型是____________。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com