D
分析:A、查出t
1℃时KNO
3的溶解度,由溶解度判断此时饱和溶液中溶质与溶液的质量关系,计算100g饱和溶液中溶质的质量;
B、根据溶液中溶质质量=溶液质量×溶质质量分数,对于t
2℃时,NaCl和KNO
3的饱和溶液中溶质的质量是否相等进行分析;
C、根据溶液中溶质质量分数=
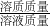
×100%,对于t
2℃时,NaCl和KNO
3的溶液中溶质的质量分数是否相等进行分析相等;
D、若t
2℃时,NaCl与KNO
3的溶解度相等,则此时两物质的溶解度曲线应交于一点;根据曲线判断t
2℃时NaCl与KNO
3的溶解度曲线是否交于一点.
解答:A、t
1℃时KNO
3的溶解度为20g,此时的饱和溶液中溶质与溶液的质量比为20:120,则此时100g饱和溶液中含KNO
3的质量=

×20≈16.7g≠20g;故A不正确;
B、根据溶液中溶质质量=溶液质量×溶质质量分数,虽然由于t
2℃时两物质的溶解度相等而饱和溶液的溶质质量分数也相等,但由于两溶液的质量没有明确,因此,不能得出饱和溶液中溶质的质量相等的判断;故B不正确;
C、虽然t
2℃时两物质的溶解度相等而饱和溶液的溶质质量分数也相等,但对于不饱和溶液,溶液中溶质质量分数=
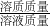
×100%,而该说法中对溶质质量、溶液质量均没有明确,因此,无法判断此时NaCl和KNO
3的溶液中溶质的质量分数的大小关系;故C不正确;
D、根据溶解度曲线图,t
2℃时,NaCl与KNO
3的溶解度曲线交于一点,说明此时两物质的溶解度相等;故D正确;
故选D.
点评:根据溶解度曲线,可以看出物质的溶解度随着温度的变化而变化的情况,可以比较在一定温度范围内的物质的溶解度大小,可以判断某温度下物质的溶解度.


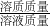 ×100%,对于t2℃时,NaCl和KNO3的溶液中溶质的质量分数是否相等进行分析相等;
×100%,对于t2℃时,NaCl和KNO3的溶液中溶质的质量分数是否相等进行分析相等; ×20≈16.7g≠20g;故A不正确;
×20≈16.7g≠20g;故A不正确;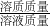 ×100%,而该说法中对溶质质量、溶液质量均没有明确,因此,无法判断此时NaCl和KNO3的溶液中溶质的质量分数的大小关系;故C不正确;
×100%,而该说法中对溶质质量、溶液质量均没有明确,因此,无法判断此时NaCl和KNO3的溶液中溶质的质量分数的大小关系;故C不正确;

 省略).
省略).