
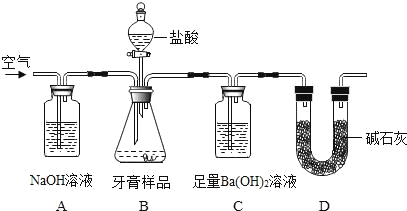
����Ŀ��Ϊ�ⶨijп��Ʒ�����ʲ���пԪ�أ�������ˮ��Ҳ���μӷ�Ӧ���Ĵ��ȣ�ʵ����̼����ݼ�¼���£�
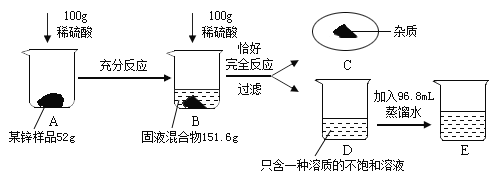
��1��ʵ���з�����Ӧ�Ļ�ѧ����ʽΪ ��
��2��������֪�����г���� A��B �μӷ�Ӧ��ϡ������������(x)�ı���ʽΪ_____��
��3���� 98%��Ũ��������ʵ�������õ�ϡ���ᣬ��Ҫ����ˮ�����Ϊ_____mL��
��4������Ʒ��п�Ĵ���Ϊ_____��
��5��E ������Һ�����ʵ���������Ϊ_____��
��6��ұ�� 65t ����п��Ʒ��������Ҫ�����ʵ�¯��ʯ����Ҫ�ɷ���̼��п��������Ϊ_____��
���𰸡���1��![]()
��2��![]()
��3��160
��4��50%
��5��20%
��6��62.5t
��������
��1��п�����ᷴӦ��������п�����������Ի�ѧ����ʽΪ![]() ��
��
�ʴ�Ϊ��![]() ��
��
��2����μӷ�Ӧ��������Ϊx����Ӧ����ٵ�����Ϊ������������=152g-151.6g=0.4g��
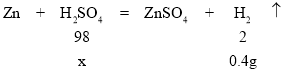
![]() ��
��
�ʴ�Ϊ��![]() ��
��
��3��������Ŀ��Ϣ��֪��200gϡ��������Ʒ��ȫ��Ӧ������100gϡ�������ʱ��п������ϡ����ȫ����Ӧ�����ݣ�2���б���ʽ���������x=19.6g������200gϡ��������������=19.6g��2=39.2g����������Ҫ98%Ũ��������Ϊm��
m��98%=39.2g��m=40g������ˮ������=200g-40g=160g�����Լ���ˮ�����=160g��1g/mL=160mL��
�ʴ�Ϊ��160��
��4����100gϡ���ᷴӦ������������Ϊy��
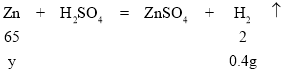
![]()
y=13g
�����ܹ�п������=2��13g=26g����Ʒ��п�Ĵ���=![]() ��
��
�ʴ�Ϊ��50%��
��5�����������غ㶨��D����Һ����Ӧ��Ϊ������������ȥ�����������ټ�ȥ���������������100gϡ��������0.4g��������200gϡ��������0.8g����������D����Һ����=200g+52g-26g-0.4g��2=225.2g����������ˮ96.8mL����ʱE����Һ����=225.2g+96.8g=322g������������п������Ϊn��
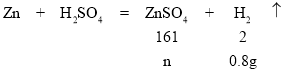
![]()
n=64.4g
������Һ������������=![]() ��
��
�ʴ�Ϊ��20%��
��5������пԪ�������غ㣬��֪̼��п��пԪ������=��Ʒ��пԪ������������¯��ʯȫ��̼��п����ʱ��Ҫ������С����������Ҫ̼��п������ΪD��
D��![]() ��D=62.5t��
��D=62.5t��
��������Ҫ¯��ʯΪ62.5t��
�ʴ�Ϊ��62.5t��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ճ������ũҵ�����벻��ˮ����ش�
(1)����ˮ�������У�������ˮ�е����������ͨ��_______������ȥ��
(2)ij����ˮ�к��н϶�����Ըơ�þ�������ˮ����______(������ˮ������Ӳˮ��)��
(3)�����ϵ��ܴ�ˮ����Ȼ�ܴ���ˮ���٣�����ˮ��Դ��ÿ����������κ�����������Ϊ���ڽ�Լ��ˮ����_____��
A ���������������ֹ�ˮ��ͷ
B����Ϸ�ˮˢ��
C ϴ��˵�ˮ��������
(4)����ͼ��ʾװ�ý��е��ˮ��ʵ�飬a��b �������������ռ���������������Ϊ_____����ʵ��֤��ˮ����______��ɵġ�
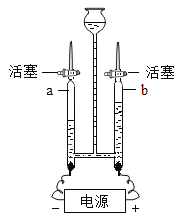
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ڼ�լ����������������ͷ�һʱ��Ϊ�ܶ���������Ļ��⣬�ܶ����ڼ��������������ӡ���������˺�������ʳ�����ݷ��ͷۣ���̼�����ƺ��л���ȣ�������ۡ�ˮ���ֱ����������ʳƷ����ʵ��˵��̼�����������ᷴӦ��̼�����Ƶ��׳ƽ�_______�����ͷ۵���Ҫ�ɷ��к���̼�����ƣ�ij��ѧ��ȤС���ͬѧ��̼�����Ƶ����ʽ�����̽����
��������̽��
һ.̽��̼�����Ƶ����ȶ���
����������]̼�������������ֽ⣬����ˮ��һ�������һ�ֳ����Ĺ������ʡ�
��ʵ��1��ȡһ��������̼�����Ʒŵ�ͭƬ�ϼ��ȣ���ͼ��ʾ��
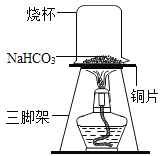
��1������һ��ʱ��۲쵽�ձ��ڱ���ˮ�顣
��2����ּ��Ⱥ��ձ�Ѹ�ٵ�ת���������������ij���ʯ��ˮ�����۲쵽ʯ��ˮ����ǣ�˵����������_______��
��3����ͨ����һ����ʵ��̽����ȷ����ּ��Ⱥ�Ĺ������ijɷ֡�
�ٿ�����Na2CO3�ڿ�����NaOH �ۿ�����_______
��ʵ��2��
ʵ����� | ʵ������ | ʵ����� |
A�����ù�����������ˮ���Ƴ���Һ��ȡ������Һ���Թ��У��μ�����ϡ���� | ��������� | ����_______������ţ������� |
B����ȡ������Һ���Թ��У��μ��������Ȼ�����Һ | _______ | �����������Na2CO3 |
C��ȡ����B���農�ú������ϲ���Һ����������_______��Һ | ���������� | ����ٳ��� |
��ʵ����ۣ�NaHCO3���ȷֽ�Ļ�ѧ����ʽΪ_______��
��������չ��ʵ��������ƿʧȥ��ǩ�Ĺ���ҩƷ����֪������̼���ƺ�̼�����ƣ�Ϊ�˼���̼���ƺ�̼���������ְ�ɫ���壬����˲�ͬ�ķ�����������ʵ�飬����ͼ��ʾ��
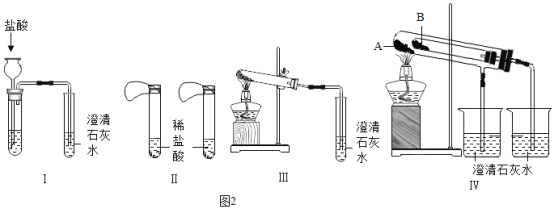
��1��ͼI��II������IV��ʾʵ�鷽���У��ܹ��ﵽʵ��Ŀ�ĵ��ǣ���װ����ţ�_______��
��2��ʵ��IV���Թ�B��װ��Ĺ��������_______��
��������̽��
Ϊ�ⶨij���ͷ���̼�����Ƶ��������������ʲ����ᷴӦ��������ͼ��װ������װ�����������ã���ȡ50g��Ʒ������ƿ�У���������ʵ�飬����Ҫʵ�鲽�����£�
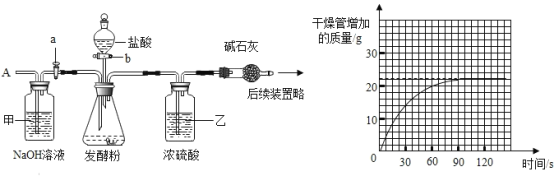
��ȷ��˳����________������ţ����ظ�ѡ��
a ����������ڼ�ʯ�ң������ƺ��������ƹ���Ļ���������
b �ر���b������a���ӵ���A����������һ�����Ŀ�����
c �رջ���a������b����������ϡ������Һ��ֱ����ƿ�ڲ��ٲ������ݣ�
��1��װ�ü�������_______��װ���ҵ�������_______��
��2��������ͼ��������ݼ�����Ʒ��̼�����Ƶ���������________��д��������̣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��ȤС���ijƷ�������е�Ħ�����ɷּ��京����������̽����
��������ϣ�
��1��������Ħ������̼��ơ�����������ɣ������������ɷ���������ʱ�����������
��2������̼��������Һ�����ն�����̼��
��3����ʯ�ҵ���Ҫ�ɷ�Ϊ�����ƺ��������ơ�
�����ʵ�飩С��ͬѧ�������ͼ��ʾװ�ã�ͼ�мг�������ȥ���ⶨ������Ʒ��̼��Ƶĺ�����
����ͼʾ�ش��������⣺
��1��Bװ��ʹ�÷�Һ©�����ŵ���_____��
��2��A������������Һ��������_____��
��3��C�й۲쵽�г�����������Ӧ�Ļ�ѧ����ʽΪ_____��
��4��ʵ����������������ͨ���������������_____��
����������ۣ���C�в�������ͨ��_____��ϴ�ӡ����������ͨ���������������Ʒ��̼��Ƶĺ�����
����˼�����ۣ�
��˼ʵ����̣�С��ͬѧ���Ӧ��ȡ��Ҫ��ʩ����߲ⶨȷ�ȡ�����������и����ʩ�У�������߲ⶨȷ�ȵ���_____������ĸ��ţ���
a �ڼ�������֮ǰ���ž�װ���ڵ�CO2����
b �����μ�������ٶ�
c ��A��B֮������ʢ��Ũ�����ϴ��װ��
d ��B��C֮������ʢ�б���̼��������Һ��ϴ��װ��
����չ���죩С��ͬѧΪȷ��A�����ʳɷ֣������������ʾʵ�飺
ʵ����� | ʵ������ | ʵ����� |
��1����ȡ������Һ���Թ��У���������____ | ������ɫ���� | ������Ҫ�ɷ�ΪNa2CO3��NaOH |
��2�������ˣ�ȡ������Һ���� | _____ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ࡢ��ȡ�Ǩ����ѧϰ��ѧ�ķ�����
��1����ʵ��Ŀ�Ŀɽ���ѧʵ���Ϊ�����о����ʵ�����������о����ʵĽṹ�������о����ʵ���������ʵ��ȡ��ݴ˿ɽ�����ʵ���е� B ��_____����A������C�� ����D������Ϊһ�࣬������____��
�����ijɷ� | ˮ����� | �Ƚ�Ӳ�� | ϡ���ᡢϡ���ữѧ�������Ƶ�ԭ�� |
|
| ����̻� |
|
A | B | C | D |
��2��̼��̼����������Խ�����Ӧ��ת����ϵ��ͼ��ʵ��ת���Ĺ����У�������̼Ԫ�صĻ��ϼ�________��
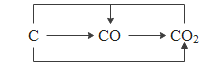
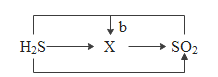
��3�����������Ӧ��ת����ϵ���ɽ����������ʼ�ķ�Ӧ��ת����ϵ��ͼ����ȹ��̻�ѧ��Ӧ���ڵĹ��ɣ�д��b���̣�����Ͷ�������ת��Ϊ X ��һ�ֲ���������ʣ��Ļ�ѧ����ʽ��_��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����գ�����ɽԺʿ��ʾ��������ୣ�C18H26ClN3��2H3PO4�������¹ڷ��������Ե�Ч�����������Ϊ��ɫ�ᾧ�Է�ĩ������ζ�ࡣ���⽥��ɫ��ˮ��Һ�����ԣ����¹����������˵��������ǣ�������
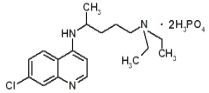
A.���������6��Ԫ�����
B.�����������Ԫ�ص������������
C.�������ˮ��Һ����ʹ��ɫ��̪�Լ����
D.ÿ��������୷�����C��H��Oԭ�Ӹ�����Ϊ18��32��8
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Դ����Խ��Խ�ܵ����ǵ�������ij����Դ������λϵͳ���Կ�����Ӧ����һ���������ǽ������ϵ�������AlN����ijAlN��Ʒ�к��в���NaOH��Һ��Ӧ�����ʣ�Ϊ�ⶨAlN�ĺ������������ʵ�鷽������֪��AlN+NaOH+H2O=NaAlO2+NH3��
������ȡһ��������Ʒ������ͼ��ʾװ�òⶨ��Ʒ��AlN�Ĵ��ȣ��г�װ������ȥ����
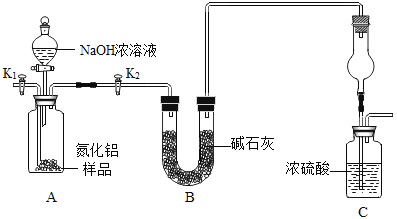
��1��AlN�е�Ԫ�ػ��ϼ�_____��
��2��ͼ��Cװ�������θ���ܵ�����_____��
��3��ʵ�������
����װ��ʵ��װ�ã�����_____���ټ���ʵ��ҩƷ��
�ڽ�������ʵ�������_____����Һ©�������������μ�NaOHŨ��Һ�����ٲ�������Ϊֹ�������μӵ�ԭ��_____��
�۴�K1����װ���ڻ���ͨ�뵪��һ��ʱ�䡣ͨ�뵪����Ŀ����_____��
�ܷ�Ӧǰ����Cװ�õ�����Ϊ200.2�ˣ���Ӧ������C�b�õ�����Ϊ203.6�ˣ���Ʒ������Ϊ9.0�ˣ�������Ʒ��AlN����������_____��д�¼�����̣�������0.1%����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ̽����������ķֽⷴӦ��ͬѧ�ǽ���������ʵ�顣
���������ϣ���������ֽ���ȡ�����������һ��Ũ��ʱ����ȼ����ȼ�ա�
������ʵ�飩
����̽����̽��Ӱ���������ֽ����ʵ�����
��� | �ձ�1 | �ձ�2 | �ձ�3 | �ձ�4 |
ʵ����� |
|
|
|
|
ʵ������ | ����ð�������ݣ��ձ����� �����������֡� | 5���Ӻ��бȽϴ���������ð���� | ����ð�������ݣ��ձ����а����� | ����ð�������ݣ��ձ����д��������� |
����̽�����ظ��ձ�1��3��4ʵ�飬���ֱ����������ľ��������ͼ��ʾ��
ʵ�鷽�� | ��� | ʵ������ |
| �ձ�1 | ľ����ȼ��ȼ�պ��� |
�ձ�3 | ľ����ȼ��֮�������� | |
�ձ�4 | ľ����ȼ��֮������Ϩ�� |
span>
����������ͣ�
��1��д���ձ�1�з�Ӧ�Ļ�ѧ����ʽ_______��
��2��Ϊ֤��MnO2��CuSO4�ܼӿ��������ķֽ����ʣ�Ӧ���ӵĶԱ�ʵ����_______��������������
��3����֤������������ҺŨ��Ӱ����ֽ����ʵ�ʵ����_____�����ձ���������ţ���
��4���ձ��ڳ��ִ���������ԭ����_______��
����˼�����ۣ�
��5���ձ�4��ľ��Ϩ���ԭ�������_______��
��6��ʵ��������˫��ˮ��ȡ���������ľ̿ȼ�յ�ʵ�飬Ӧѡ����Լ���_______������ĸ��ţ���
A5%����������Һ B10%����������Һ
C20%����������Һ D��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ����Լ30������Ĺ���ij����·�����෭������й¶��ɢ������ɫ����������ʯ��ʯ���棬����˻˻���������������ݣ�й¶���������������·�ߵ���ˮ������ζʮ�ִ̱ǣ�

��1���������Ϣ��֪����������������� _________ ����дһ����
��2�����������ֽ����ɶ������������⣬������ˮ��ռ�����������Լ21%�����壬ʵ���ұ�������Ӧ�ܷ⣬�ڹⱣ������ɫƿ�ڣ����ڵ������������������ֽ�Ļ�ѧ����ʽΪ _________
��3��Ϊ��������Ի�������Ⱦ����й¶������봦���������Ϻ������Ի�����ȾС�Ļ�ѧ���������� ________ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com