
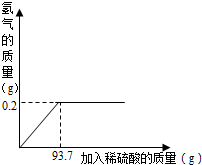
 我国约在南北朝时就开始冶炼黄铜,黄铜是铜和锌的合金(Cu-Zn),它可用来制造电器零件及日用品.为了测定某黄铜样品中铜的质量分数,取10g该样品向其中加入一定量的稀硫酸,恰好完全反应,产生氢气的质量与加入稀硫酸的质量关系如图所示.请解答下列问题:
我国约在南北朝时就开始冶炼黄铜,黄铜是铜和锌的合金(Cu-Zn),它可用来制造电器零件及日用品.为了测定某黄铜样品中铜的质量分数,取10g该样品向其中加入一定量的稀硫酸,恰好完全反应,产生氢气的质量与加入稀硫酸的质量关系如图所示.请解答下列问题:| 65 |
| 2 |
| x |
| 2g |
| 10g-6.5g |
| 10g |
| 65 |
| 2 |
| x |
| 2g |
| 10g-6.5g |
| 10g |


科目:初中化学 来源:轻巧夺冠优化训练·人教版·九年级化学下 题型:038
我国约在南北朝时就开时冶铸黄铜,黄铜是铜和锌的合金,它可用来制造机器、电器零件及日用品.为了测定某黄铜样品中铜的质量分数,取
10g黄铜加入到50g稀硫酸中,恰好完全反应,产生氢气0.1g.试求:(1)该黄铜样品中铜的质量分数;
(2)原稀硫酸中溶质的质量分数.
查看答案和解析>>
科目:初中化学 来源:1+1轻巧夺冠·优化训练 化学 九年级下册 (人教版) 银版 人教版 银版 题型:038
我国约在南北朝时就开时冶铸黄铜,黄铜是铜和锌的合金,它可用来制造机器、电器零件及日用品.为了测定某黄铜样品中铜的质量分数,取10 g黄铜加入到50 g稀硫酸中,恰好完全反应,产生氢气0.1 g.试求:
(1)该黄铜样品中铜的质量分数;
(2)原稀硫酸中溶质的质量分数.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com