
分析 (1)紫色石蕊试液的变色规律:“酸红碱蓝”;
(2)依据溶液的质量与该溶液的溶质质量分数可求该溶液中的溶质的质量;
(3)依据反应的氢氧化钠质量以及化学反应的方程式可求反应的硫酸的质量,进而可求硫酸溶液的溶质质量分数.
解答 解:(1)根据题意“为了测定某硫酸厂的废水中硫酸的质量分数”,则说明有酸,故废水中滴加紫色石蕊显红色;
(2)80g氢氧化钠溶液中溶质的质量为80g×10%=8g;
(3)解:设废水中硫酸的质量为x
2NaOH+H2SO4═Na2SO4+2H2O
80 98
8g x
则$\frac{80}{8g}=\frac{98}{x}$,解得x=9.8g
废水中硫酸的质量分数为$\frac{9.8g}{100g}$×100%=9.8%
故答案为:(1)红;(2)8;(3)9.8%.
点评 本题主要考查学生运用化学方程式进行计算的能力,数量掌握相关的溶液及化学方程式基本计算是解题的关键所在.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 物质 | 肥皂水 | 雨水 | 糖水 | 柠檬汁 | 洗洁精 |
| pH | 10.2 | 5.2 | 7.0 | 2.5 | 12.2 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
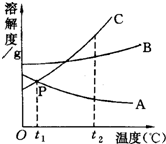 如图是A、B、C三种物质的溶解度曲线,据图回答:
如图是A、B、C三种物质的溶解度曲线,据图回答:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
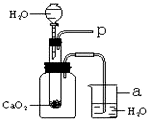 小强在回家的途中经过一鱼塘边时,发现养鱼师傅向鱼塘中撒一种微黄色的固体,鱼塘中顿时产生大量气泡,经咨询得知,这种固体的主要成分是过氧化钙(CaO2),请你与小强共同探究.
小强在回家的途中经过一鱼塘边时,发现养鱼师傅向鱼塘中撒一种微黄色的固体,鱼塘中顿时产生大量气泡,经咨询得知,这种固体的主要成分是过氧化钙(CaO2),请你与小强共同探究.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com