
如图所示是铜粉和氧气反应生成氧化铜时,参与反应的铜粉质量与产物氧化铜的质量关系图,根据图分析氧化铜中铜和氧的质量比应约为
[
]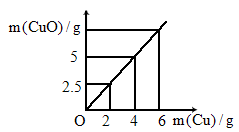
|
A .8 |
B .4 |
C .2 |
D .1 |
科目:初中化学 来源: 题型:
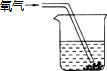 某校课外活动小组模拟工业生产方法,用金属铜粉制取少量硫酸铜.请根据他们的实验操作,回答下面有关问题:
某校课外活动小组模拟工业生产方法,用金属铜粉制取少量硫酸铜.请根据他们的实验操作,回答下面有关问题:
查看答案和解析>>
科目:初中化学 来源: 题型:
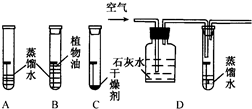
 (2009?石景山区二模)回答下列问题.
(2009?石景山区二模)回答下列问题.
| ||
| ||
查看答案和解析>>
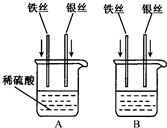
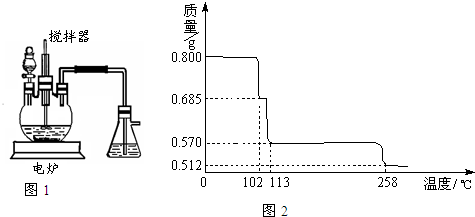
科目:初中化学 来源: 题型:阅读理解
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
 汽车是现代生活中不可缺少的代步工具.请回答下列问题:
汽车是现代生活中不可缺少的代步工具.请回答下列问题:
| ||
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com