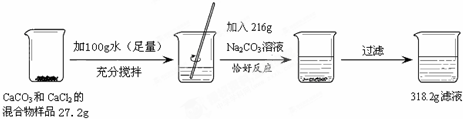
分析:(1)原固体混合物样品27.2g,加入100g水,再加入216g碳酸钠,此时物质的质量总和是27.2g+100g+216g=343.2g,可过滤后质量变成了318.2g,质量减少的原因是把原混合物中的碳酸钙以及氯化钙和碳酸钠反应生成的碳酸钙给过滤出去了,因此过滤出的碳酸钙的质量是27.2g+100g+216g-318.2g=25g.据化学反应Na2CO3+CaCl2=CaCO3↓+2NaCl和元素质量守恒可知原混合物中氯化钙中的钙元素全部进入了生成的碳酸钙中,因此过滤出来的碳酸钙中的钙元素的质量就等于原混合物中钙元素的质量.这样计算出过滤出的碳酸钙中钙元素的质量,再利用质量分数公式就可以计算出原固体混合物样品中钙元素的质量分数.
(2)因为加入216g碳酸钠溶液时,氯化钙和碳酸钠恰好完全反应,原混合物中的碳酸钙和生成的碳酸钙有都给过滤出去了,因此反应后溶液中的溶质只是生成的氯化钠.根据化学方程式Na2CO3+CaCl2=CaCO3↓+2NaCl找出各物质之间的质量关系,然后设原混合物中碳酸钙的质量为x,利用化学方程式就可计算出原混合物中氯化钙的质量,从而计算出生成的氯化钠的质量,再利用质量分数的公式就可计算出反应后溶液中溶质的质量分数.
解答:解:(1)过滤出的碳酸钙的质量是:27.2g+100g+216g-318.2g=25g
25g碳酸钙中钙元素的质量是:25g×
×100%=10g
原固体混合物样品中钙元素的质量分数:
×100%≈36.8%
(2)设原混合物中碳酸钙的质量是x,生成的氯化钠的质量为y,则原混合物中氯化钙的质量是27.2g-x,生成的碳酸钙的质量是25g-x.
Na
2CO
3+CaCl
2=CaCO
3↓+2NaCl
111 100 117
27.2g-x 25g-x y
111:100=(27.2g-x):( 25g-x)
解得:x=5g
100:117=(25g-5g):y
解得:y=23.4g
所以反应后溶液中溶质的质量分数:
×100%≈7.4%
答:反应后溶液中溶质的质量分数7.4%.
点评:本题是利用图表的方式来分析和解决化学计算中的有关问题,要求学生有较强的识图能力和数据分析能力.



 阅读快车系列答案
阅读快车系列答案

