解:(1)②双氧水是一种无色液体,二氧化锰是固体;反应条件不需要加热;氧气的密度大于空气的密度且不易溶于 水.其反应的化学方程式为2H
2O
2
2H
2O+O
2↑;
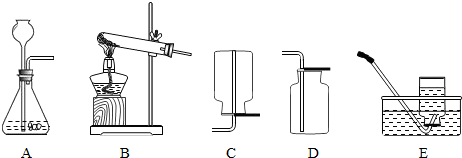
③用双氧水和二氧化锰制取氧气,可当做固液反应制取气体,反应不需要加热,发生装置选用 A,由于氧气的密度大于于空气的密度,可利用向上排空法收集氧气,收集装置选用D,又由于氧气不易溶于水,可利用排水法收集氧气,收集装置选用E;
(2)①分析实验的目的是:在实验室中制取氨气;
②收集有关资料:NH
4Cl和Ca(OH)
2都为固体,反应需要加热,NH
3密度小于空气,极易溶于水;反应原理:NH
4Cl+Ca(OH)
2
CaCl
2+2H
2O+2NH
3↑;
③用加热固体NH
4Cl和Ca(OH)
2混合物的方法制取氨气,属于加热固体制取气体,发生装置选用 A,由氨气的密度小于空气的密度,氨气极易溶于水,可用向下排气法收集氨气,收集装置选用C.
故答为:(1)②液体,固体,不需要加热,大,不易,2H
2O
2
2H
2O+O
2↑,③A,D或E;
(2)①在实验室中制取氨气; ②NH
4Cl和Ca(OH)
2都为固体,反应需要加热,NH
3密度小于空气,极易溶于水;反应原理:NH
4Cl+Ca(OH)
2
CaCl
2+2H
2O+2NH
3↑③B,C;
分析:(1)②、根据双氧水、二氧化锰、氧气的性质分析填空,根据反应物、生成物反应条件写出反应的化学方程式;
③、根据反应物的状态和反应条件确定反应的发生装置,根据氧气的收集方法确定收集装置;
(2)①、分析实验的目的;
②根据实验的目的要收集有关NH
4Cl、Ca(OH)
2和NH
3性质的知识、实验的原理;
③根据反应物的状态和反应条件确定反应的发生装置,根据氨气的收集方法确定收集装置;
点评:本题主要考查了实验室有关气体的制取,在学习中要熟记常用气体的发生装置和收集装置与选取方法及其依据,并根据气体的制取原理来组装、选配、判断或者选择气体的发生装置;再根据气体的溶解性、密度及其是否与水或者空气发生反应等来判断、选用收集装置;

 2H2O+O2↑;
2H2O+O2↑; CaCl2+2H2O+2NH3↑;
CaCl2+2H2O+2NH3↑; 2H2O+O2↑,③A,D或E;
2H2O+O2↑,③A,D或E; CaCl2+2H2O+2NH3↑③B,C;
CaCl2+2H2O+2NH3↑③B,C;
