��2012?����ҵ�������Ҫ�ɷ���Fe
2O
3��������������FeO��Fe
3O
4��Ϊ�˲ⶨ����������������������ȤС���ͬѧ���������µ�ʵ�飬���������̷�����
������1�����ᾧ�壨H
2C
2O
4?3H
2O����Ũ�������������ȷֽ⣬��ѧ����ʽΪ��
H
2C
2O
4?3H
2O
CO
2��+CO��+4H
2O
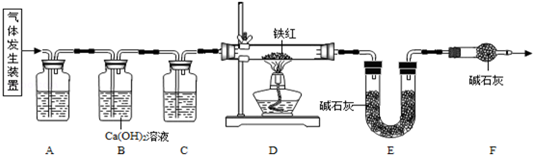
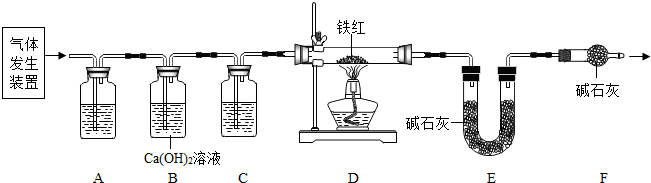
��1�����п���������ֽ���ȡ�����װ����
d
d
������ĸ��ţ�
���������ۡ�����ͼ��ʾװ�ý���ʵ�飺
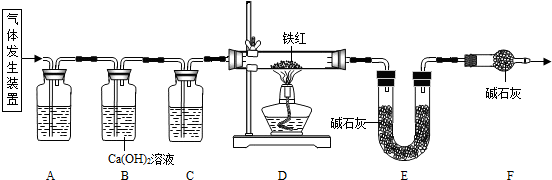
��2��ʵ��ǰӦ��
���װ�õ�������
���װ�õ�������
��
��3������D�е������Ǵ����������CO����A��C�е��Լ�������
c
c
��
a
a
������ĸ��ţ�
a��Ũ���� b������ʯ��ˮ c������������Һ
��4��Bװ�õ�������
��֤������̼�ѳ���
��֤������̼�ѳ���
��
��5����Dװ�ü���ǰ��ֹͣ���Ⱥ�Ҫͨ�������CO�������÷ֱ��ǣ��ټ���ǰ
��װ���еĿ����ų�����ֹ������ը
��װ���еĿ����ų�����ֹ������ը
��ֹͣ���Ⱥ�
����װ���������Ķ�����̼��ʹ��ȫ����Eװ���м�ʯ��ȫ������
����װ���������Ķ�����̼��ʹ��ȫ����Eװ���м�ʯ��ȫ������
��
��6��д��Dװ������������Ӧ��һ����ѧ����ʽ
��
�����ݷ�������㡿
������2�����ij�������������������������
| ���������� |
FeO |
Fe2O3 |
Fe3O4 |
| ������������ |
77.8% |
70.0% |
72.4% |
��7����ȡ������Ʒ10.0g��������װ�ý���ʵ�飬�ⶨ��������������������
��D�г�ַ�Ӧ��õ�Fe�۵�����Ϊmg����
7.0
7.0
��m��
7.78
7.78
��
��ʵ��ǰ��Ƶ�Eװ������6.6g�������������������������
76.0%
76.0%
��
��ʵ�鷴˼��
��˼1����ʵ�������ȱ��Cװ�ã��������������أ���������Ʒ����������������
ƫС
ƫС
���ƫС���������䡱��ƫ����
��˼2����ָ�����������ۡ���ʵ��װ�õ�һ������ȱ��
ȱ��β������װ��
ȱ��β������װ��
��

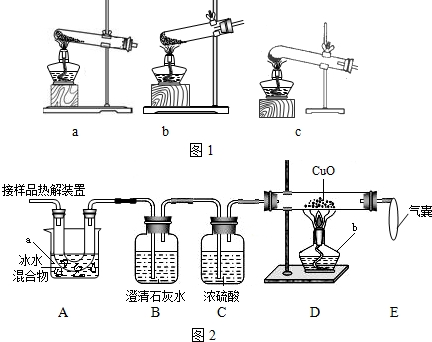
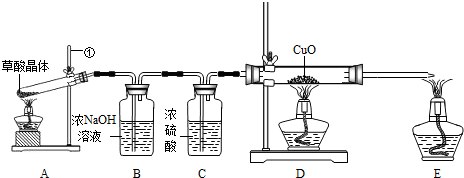
 CO��+CO2��+3H2O��ijʵ��С��Ϊ�������ֽ�������Ƿ���CO�����������ͼ��ʾ��ʵ��װ�ã��ش������й����⣺
CO��+CO2��+3H2O��ijʵ��С��Ϊ�������ֽ�������Ƿ���CO�����������ͼ��ʾ��ʵ��װ�ã��ش������й����⣺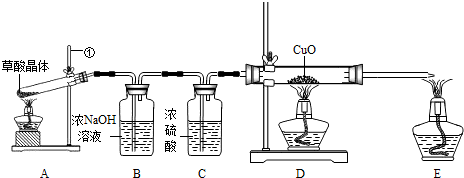
 Cu+CO2
Cu+CO2 Cu+CO2��
Cu+CO2��