春天去郊游野炊是件快乐之事.然而,在野炊中,如果遇到下面一些问题,你是如何处理的?
(1)在引燃细枯枝后,小丽迅速往“灶”里塞满枯枝,结果反而燃烧不旺,并产生很多浓烟,其原因是 ;
(2)小明带了一种新型“即热饭盒”(底部有两层:一层存放水,另一层存放镁和铁的混合物)的.使用时打开隔离层,即发生以下反应:Mg+2H2O═X+H2↑,X的化学式是 ,推断的依据是 ;
(3)同学们在郊游中找到了井水,井水通常为硬水.那么你会通过 的方法将井水软化为软水
(4)日本核电站爆炸主要是源于水在高温下与金属锆(Zr)管道发生反应生成氧化锆(ZrO2)和氢气,氢气与空气混合而发生爆炸.请写出水与锆反应的方程式 .
【答案】
分析:(1)根据充分燃烧的条件分析,产生很多浓烟说明燃烧不充分,进入的空气(氧气)少造成的;
(2)利用质量守恒定律及化学反应方程式来推断X的化学式;
(3)根据硬水的软化方法分析;
(4)根据化学方程式的书写方法进行分析.
解答:解:(1)促进可燃物燃烧的条件有两个:增大可燃物与氧气的接触面积,增大氧气浓度,迅速往“灶”里塞满枯枝,进入的空气少,可燃物与氧气的接触面积小了,燃烧会不充分;故填:迅速往“灶”里塞满枯枝,进入的空气少,可燃物与氧气的接触面积小了,燃烧会不充分;
(2)由反应Mg+2H
2O═X+H
2↑,根据质量守恒定律可知,反应前后的元素种类和原子的种类和个数不变,反应前有1个镁原子、4个氢原子、2个氧原子,则反应后共有1个镁原子、4个氢原子、2个氧原子,反应后已经有2个氢原子,则X中含有1个镁原子、2个氢原子、2个氧原子,则化学式为Mg(OH)
2,故答案为:Mg(OH)
2;质量守恒定律;
(3)硬水中含有较多的可溶性钙镁化合物,加热能转化生成不溶性钙镁化合物,通过煮沸的方法可将井水软化为软水,故填:煮沸;
(4)金属锆在高温下能与水反应生成氧化锆和氢气,在高温下水是气体,生成的氢气不需要使用气体符号,故填:Zr+2H
2O(气态)
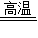
ZrO
2+2H
2.
点评:解答本题要掌握多方面方面的化学知识,例如化学式的推断、促进燃烧的条件等,只有这样才能对相关方面的问题做出正确的判断.

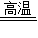 ZrO2+2H2.
ZrO2+2H2.

 阅读快车系列答案
阅读快车系列答案