
 钠是一种非常活泼的金属,它可以和冷水直接反应生成氢气:2Na+2H2O=2NaOH+H2↑,但是它与煤油不会发生反应.
钠是一种非常活泼的金属,它可以和冷水直接反应生成氢气:2Na+2H2O=2NaOH+H2↑,但是它与煤油不会发生反应.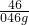 =
=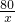
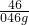 =
=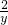
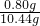 ×100%≈7.7%.
×100%≈7.7%.

科目:初中化学 来源: 题型:
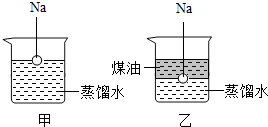
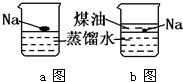 32、钠是一种非常活泼的金属,它可以和冷水直接反应生成氢气:2Na+2H2O=2NaOH+H2↑但它不与煤油反应.把一小块银白色的金属钠投入盛有蒸馏水的烧杯中(如图a),可以看到钠浮在水面上,与水发生剧烈反应,反应放出的热量使钠熔成小球,甚至会使钠和生成的氢气都发生燃烧.如果在上述盛蒸馏水的烧杯中先注入一些煤油,
32、钠是一种非常活泼的金属,它可以和冷水直接反应生成氢气:2Na+2H2O=2NaOH+H2↑但它不与煤油反应.把一小块银白色的金属钠投入盛有蒸馏水的烧杯中(如图a),可以看到钠浮在水面上,与水发生剧烈反应,反应放出的热量使钠熔成小球,甚至会使钠和生成的氢气都发生燃烧.如果在上述盛蒸馏水的烧杯中先注入一些煤油,查看答案和解析>>
科目:初中化学 来源: 题型:
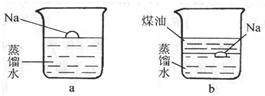 31、钠是一种非常活泼的金属,它可以和冷水直接反应生成氢氧化钠和氢气,但是它与煤油不会发生反应.把一小块银白色的金属钠投入盛有蒸馏水的烧杯中(如图a所示).可以看到钠块浮在水面上,与水发生剧烈反应,反应放出的热量使钠熔成小球,甚至会使钠和生成的氢气都发生燃烧.如果在上述盛蒸馏水的烧杯中先注入一些煤油,再投入金属钠,可以看到金属钠悬浮在煤油和水的界面上(如图b所示),同样与水发生剧烈的反应,但是不发生燃烧.
31、钠是一种非常活泼的金属,它可以和冷水直接反应生成氢氧化钠和氢气,但是它与煤油不会发生反应.把一小块银白色的金属钠投入盛有蒸馏水的烧杯中(如图a所示).可以看到钠块浮在水面上,与水发生剧烈反应,反应放出的热量使钠熔成小球,甚至会使钠和生成的氢气都发生燃烧.如果在上述盛蒸馏水的烧杯中先注入一些煤油,再投入金属钠,可以看到金属钠悬浮在煤油和水的界面上(如图b所示),同样与水发生剧烈的反应,但是不发生燃烧.查看答案和解析>>
科目:初中化学 来源: 题型:
 (2002?海南)钠是一种非常活泼的金属,将其投入水中,它会浮在水面上与水发生剧烈反应,放出大量的热,使自身熔化成小球,甚至使生成的氢气燃烧.其反应的化学方程式为2Na+2H2O=2NaOH+H2↑.但它不与煤油反应,因而可将其保存在煤油里.
(2002?海南)钠是一种非常活泼的金属,将其投入水中,它会浮在水面上与水发生剧烈反应,放出大量的热,使自身熔化成小球,甚至使生成的氢气燃烧.其反应的化学方程式为2Na+2H2O=2NaOH+H2↑.但它不与煤油反应,因而可将其保存在煤油里.查看答案和解析>>
科目:初中化学 来源: 题型:
 钠是一种非常活泼的金属,露置在空气中会很快与氧气反应生成氧化物,写出该反应的化学方程式
钠是一种非常活泼的金属,露置在空气中会很快与氧气反应生成氧化物,写出该反应的化学方程式查看答案和解析>>
科目:初中化学 来源: 题型:
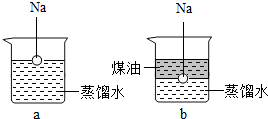 钠是一种非常活泼的金属,它可以和冷水直接反应生成氢氧化钠和氢气,但是它与煤油不会发生反应.把一小块银白色的金属钠投入盛有蒸馏水的烧杯中(如图a所示).可以看到钠块浮在水面上,与水发生剧烈反应,反应放出的热量使钠熔成小球,甚至会使钠和生成的氢气都发生燃烧.如果在上述盛蒸馏水的烧杯中先注入一些煤油,再投入金属钠,可以看到金属钠悬浮在煤油和水的界面上(如图b所示),同样与水发生剧烈的反应,但是不发生燃烧.
钠是一种非常活泼的金属,它可以和冷水直接反应生成氢氧化钠和氢气,但是它与煤油不会发生反应.把一小块银白色的金属钠投入盛有蒸馏水的烧杯中(如图a所示).可以看到钠块浮在水面上,与水发生剧烈反应,反应放出的热量使钠熔成小球,甚至会使钠和生成的氢气都发生燃烧.如果在上述盛蒸馏水的烧杯中先注入一些煤油,再投入金属钠,可以看到金属钠悬浮在煤油和水的界面上(如图b所示),同样与水发生剧烈的反应,但是不发生燃烧.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com