
| 反应前 | 反应后 | ||
| 实验 数据 | 盐酸溶液 的质量 | 烧杯和黄铜样品 的质量 | 烧杯和剩余物 的质量 |
| 50.0g | 63.0g | 112.9g | |
科目:初中化学 来源:不详 题型:计算题
| 实验次数 | 第1次 | 第2次 | 第3次 | 第4次 | 第5次 |
| 反应后剩余固体的质量(g) | 17.4 | 14.8 | 12.2 | 10.8 | 10.8 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:推断题
查看答案和解析>>
科目:初中化学 来源:不详 题型:多选题
| ||
| A.反应后生成CO2的质量为12.4g |
| B.反应后CO2和H2O的质量比为22:9 |
| C.原混合物中NaHCO3的质量为16.8g |
| D.原混合物中Na2CO3的质量分数为16% |
查看答案和解析>>
科目:初中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:初中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:初中化学 来源:不详 题型:问答题
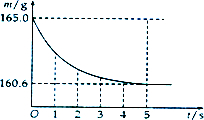
查看答案和解析>>
科目:初中化学 来源:不详 题型:问答题
| A.Na | B.Al | C.Zn | D.Mg |
查看答案和解析>>
科目:初中化学 来源:不详 题型:问答题
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com