


科目:初中化学 来源: 题型:
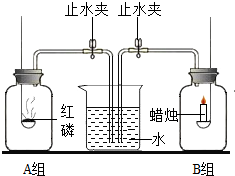 化学课上,陈老师说:“空气是人类和一切动植物的生命支柱,那么空气是由哪些物质组成的呢?请同学们设计不同测定空气中氧气含量的实验方案”.几分钟后,我们设计了如图所示A、B二组装置进行实验探究.
化学课上,陈老师说:“空气是人类和一切动植物的生命支柱,那么空气是由哪些物质组成的呢?请同学们设计不同测定空气中氧气含量的实验方案”.几分钟后,我们设计了如图所示A、B二组装置进行实验探究.查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源:2011年浙江省温州市苍南县新安店中学中考化学模拟试卷(一)(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com