
【题目】化学兴趣小组对某品牌牙膏中碳酸钙的含量进行以下探究。
(查得资料)该牙膏摩擦剂主要由碳酸钙组成,其他成分遇到盐酸时无气体生成。
(进行实验)利用如图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定B中生成的沉淀质量,以确定碳酸钙的质量分数。
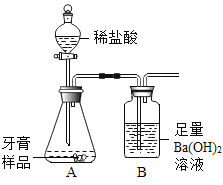
(1)写出B中反应的化学方程式__________________。
(2)准确称取8.00g样品三份,进行测量。待A中不再产生气体后停止滴加盐酸,将B中沉淀过滤,洗涤,干燥,测得沉淀平均质量为3.94g。则样品中碳酸钙的质量分数为_________。
(3)若过滤所得沉淀未经洗涤即干燥称量,测定结果偏大。请简述判断沉淀是否洗涤干净的方法________________。
(4)若计算值比实际值偏小,原因是_________________。
(5)小芳认为不必测定B中沉淀的质量,只要测定装置B在实验前后的质量差,一样可以确定碳酸钙的质量分数且操作更为简洁。你同意她的说法吗?为什么?_______________。
【答案】CO2 + Ba(OH)2 = BaCO3↓+ H2O 25% 取最后一次的洗涤液,向其中加入酚酞溶液,若酚酞不变色,则证明沉淀已经洗净 反应生成的CO2没有被Ba(OH)2溶液全部吸收(锥形瓶内有残留) 不同意。A中水蒸气、氯化氢气体等进入装置B中导致测定二氧化碳的质量偏大
【解析】
(1)A中盐酸与碳酸钙反应生成的二氧化碳与B中的氢氧化钡溶液反应生成碳酸钡的沉淀和水,反应的化学方程式为:CO2 + Ba(OH)2 = BaCO3↓+ H2O;
(2)设碳酸钙的质量为x。
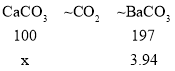
![]()
x=2g
样品中碳酸钙的质量分数为:![]() ×100%=25%
×100%=25%
(3)取最后一次的洗涤液,向其中加入酚酞溶液,若酚酞不变色,则证明沉淀已经洗净;
(4)若计算值比实际值偏小,原因是:反应生成的CO2没有被Ba(OH)2溶液全部吸收(锥形瓶内有二氧化碳残留);
(5)不同意。A中水蒸气、氯化氢气体等进入装置B中导致测定二氧化碳的质量偏大,测定的碳酸钙的质量偏大,碳酸钙的质量分数偏高。


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:初中化学 来源: 题型:
【题目】如图是甲、乙两种物质的溶解度曲线,下列说法正确的是( )

A.若乙固体中含有少量甲,可采用降温结晶的方法提纯乙
B.将甲、乙两种物质的不饱和溶液变为饱和溶液,可以采用相同的方法
C.分别将等量的甲、乙的饱和溶液从 t3℃降温到 t2℃,所得溶液的溶质的质量分数相同
D.用 20%的甲溶液配制 220g 溶质质量分数为 10%的甲的稀溶液,需要加水的质量为 60g
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是甲、乙、丙三种物质的溶解度曲线,下列分析正确的是(__________)
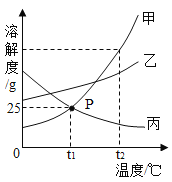
A t1℃时,把25g甲放入50g水中,能得到甲的饱和溶液,且该饱和溶液中溶质和溶剂的质量比为1:2
B 三种物质的溶解度由大到小的顺序是甲>乙>丙
Ct2℃时,把等质量的甲、乙、丙三种物质配制成饱和溶液,所需溶剂质量最小的是甲物质
D 将t2℃时甲、乙、丙三种物质的饱和溶液降温至t1℃,三种溶液中溶质质量分数由大到小的顺序是________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】向一定量![]() 和
和![]() 的混合溶液中逐渐加入足量锌粒,如图是反应过程中氧化亚铁的质量变化情况:
的混合溶液中逐渐加入足量锌粒,如图是反应过程中氧化亚铁的质量变化情况:
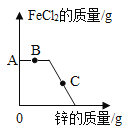
(1)B点时,反应的化学方程式为________;
(2)C点时,溶液中的溶质有________;
(3)C点与A点相比,溶液质量________(填“增加”、“减小”或“不变”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】以太阳能为热源经由铁氧化合物循环分解水的过程如图所示。下列说法错误的是( )
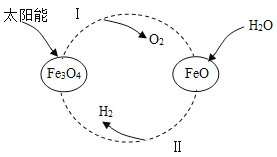
A.过程中,铁、氢、氧元素的化合价都发生了变化
B.该过程实现了太阳能向化学能的转化
C.过程I的化学方程式为 2Fe3O4 6FeO+O2↑
6FeO+O2↑
D.过程II属于置换反应
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】将CO和CO2的混合气体10g,在高温下缓慢通过足量的氧化铁后,再把得到的气体通入足量的澄清石灰水中,过滤、干燥,得到30g白色沉淀,则原混合气体中CO 和 CO2的质量比为
A.14∶11B.7∶11C.2∶1D.1∶2
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】碳酸锂广泛应用于陶瓷和医药等领域。以β-锂辉石(主要成分为Li2O·Al2O3·4SiO2)为原料制备Li2CO3的工艺流程如下:
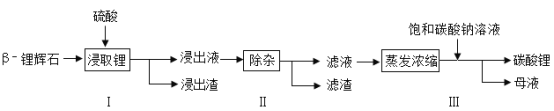
已知:Fe3 +、Al3 +、Fe2 +和Mg2 +以氢氧化物形式完全沉淀时,溶液的pH分别为 3.2、5.2、9.7和12.4;Li2SO4、LiOH和Li2CO3在30℃下的溶解度分别为34.2 g、12.7 g和1.3g。
(1)步骤I前,β-锂辉石要粉碎成细颗粒的目的是__________________。
(2)步骤I中,酸浸后得到的酸性溶液除含有Li+、SO42-,还含有Al3+、Fe3+、Fe2+、Mg2+、Ca2+、Na+等杂质,需在搅拌下加入_________(填“石灰石”、 “氯化钙”或“稀硫酸”)以调节溶液的pH到6.0~6.5,使Al3+、Fe3+形成沉淀,然后分离得到浸出液。
(3)步骤II中,将适量的H2O2溶液、石灰乳和Na2CO3溶液依次加入浸出液中,可除去的杂质金属离子有_______________________。
(4)从母液中可回收的主要物质是__________________________ 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】日常生活中常采用煮沸方法将硬水软化。这种方法一定可靠吗?
(查阅资料)水的硬度由水中所溶解的可溶性钙镁化合物引起的,硬水中所溶解的钙镁化合物可分为两类:钙、镁的碳酸氢盐,如Ca(HCO3)2等;钙、镁的硫酸盐或氯化物,如CaCl2等,一般所说水的硬度是由上述两类化合物引起的。
(设计并实验)小明为方便研究准备了碳酸氢钙溶液和氯化钙溶液来代表两类不同的钙、镁化合物。
实验编号 | 实验操作 | 实验现象 |
① | 分别取5mL的碳酸氢钙溶液和氯化钙溶液于A. B两支试管中,同时加热 | A试管中产生大量气泡,有沉淀产生,B试管无明显现象 |
② | 在上述实验后,分别滴加4滴肥皂水,振荡 | A试管中有大量的泡沫,B试管中泡沫较少 |
(得出结论)
(1)煮沸实际上只能降低____________所引起的水的硬度。实验中A试管中碳酸氢钙分解除产生沉淀外,还生成了另外两种氧化物,请写出该反应的化学方程式_______________。
(评价与反思)
①小芳同学提出,若向碳酸氢钙溶液中滴加少量酚酞溶液,溶液变为红色,则说明__________________。
②在实验室中一般可通过___________来降低水的硬度,硬水会给我们的生活和生产带来很多危害,请写出一种___________________________________________________。
(实验拓展)向澄清石灰水中持续通CO2气体,会得到Ca(HCO3)2溶液。利用pH传感器测定在此操作过程中pH变化曲线如图所示:请写出两条现象或结论。
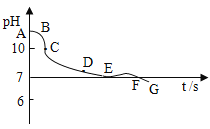
①______________________________________。
②______________________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】有一包白色固体粉末,可能含有CuSO4、Na2SO4、(NH4)2CO3、BaCl2、NH4Cl、KCl中的一种或几种.现做如下实验:
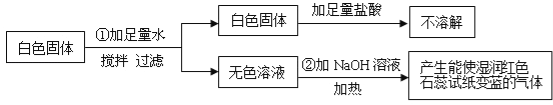
根据上述实验现象判断:
(1)白色固体中一定不含 ,一定含有 ,可能含有 .
(2)写出①中化学反应方程式 .
(3)写出②中化学反应方程式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com