
以下是铁元素在元素周期表中的部分信息和四种粒子的结构示意图。
?? 
(1)用化学用语填空:①2个铁原子________;②2个铁离子_________;③氢氧化铁中铁元素显+3价_________。
(2)写出一条从图A中获得的信息:_____________________________。
(3)B粒子结构示意图中X的值是___? ______。
(4)B、C、D、E中,属于同种元素的是___________(填字母,下同),属于离子的是_____________。
(1)①2Fe ② 2Fe3+?? ③ (2)铁元素的相对原子质量为55.85 等
(2)铁元素的相对原子质量为55.85 等
(3)8? (4)? CE;E
【解析】
试题分析:(1)有关铁的化学用语——原子符号、离子符号、化合物中铁元素化合价的考查,(2)图A是元素在周期表中表示方法,从中可获得元素名称、元素符号、原子序数(质子数)、相对原子质量等信息,以上任填一个即可;(3)B、C、D、E是元素原子(或离子)结构示意图,据核外电子排布规律可知:B中X的值应是8;(4)同种元素的原子质子数是相等的,所以C、E属于同种元素;质子数与核外电子数不等的属于离子,所以属于离子的应是E。
考点:化学用语的考查;核外电子排布、结构示意图及元素种类与离子的考查


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:

 ,是一种活动性比铁强的金属.写出锂离子的符号
,是一种活动性比铁强的金属.写出锂离子的符号查看答案和解析>>
科目:初中化学 来源: 题型:
 在宏观、微观和符号之间建立联系是化学学科的特点.
在宏观、微观和符号之间建立联系是化学学科的特点.| 物质 | B |
C | D |  -氢原子 -氢原子 -氧原子 -氧原子 -碳原子 -碳原子 |
| 微观示意图 |  |
 |
 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
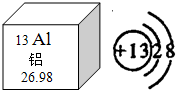 铝被称为“年轻的金属”,据世界化学史记载,金属铝是在1825年才被英国化学家戴维制得.今天,铝已经进入了我们生活的每一个角落.
铝被称为“年轻的金属”,据世界化学史记载,金属铝是在1825年才被英国化学家戴维制得.今天,铝已经进入了我们生活的每一个角落.
| ||
| ||
| ||
| ||
| 实验方案 | 实现现象 | 结论 |
| ①取一定量的合金粉末,加过量的30%NaOH溶液,充分反应后过滤,滤渣备用. | 粉末部分溶解,并有气体放出. | 合金中一定含有 铝 铝 . |
| ②取步骤①所得滤渣,加过量的 10%盐酸 10%盐酸 ,充分反应. |
滤渣部分溶解,并有气体放出,溶液呈浅绿色. | 合金中一定含有 铁和铜 铁和铜 . |
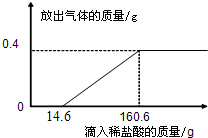
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com