(2013?成都)通过晾晒海水或煮盐井水、盐湖水等,可以蒸发除去水分得到粗盐.粗盐中含有难溶性杂质(泥沙等)和多种可溶性杂质(氯化镁、氯化钙等).
[提出问题]如何才能将粗盐中难溶性杂质和可溶性杂质(氯化镁、氯化钙)除去,从而获得较纯的食盐晶体?
[资料准备]
| 20℃时,一些物质的溶解度 |
|
OH- |
CO32- |
| Na+ |
溶 |
溶 |
| Ca2+ |
微 |
不 |
| Mg2+ |
不 |
微 |
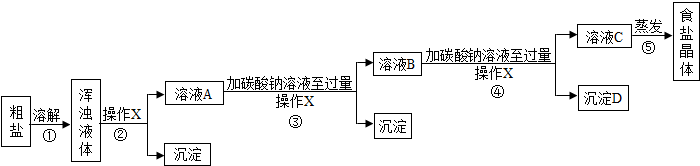
[实验方案]某同学为了提纯粗盐,设计了如下实验方案并进行实验.
[交流与表达]
(1)实验步骤①和②的目的是
除去粗盐中的难溶性杂质
除去粗盐中的难溶性杂质
;实验步骤③和④的目的是
除去粗盐中的易溶性杂质CaCl2、MgCl2
除去粗盐中的易溶性杂质CaCl2、MgCl2
.
(2)实验操作X的名称是
过滤
过滤
,该操作中要用到的玻璃仪器有烧杯、玻璃棒和
漏斗
漏斗
.
(3)实验步骤③的主要目的是
MgCl2+2NaOH═Mg(OH)2↓+2NaCl
MgCl2+2NaOH═Mg(OH)2↓+2NaCl
(用化学方程式回答);判断氢氧化钠溶液已过量的方法是
取样品少许,加入试管中,滴加酚酞试液,溶液变红色
取样品少许,加入试管中,滴加酚酞试液,溶液变红色
.
(4)实验步骤④中生成的沉淀D是
碳酸钙
碳酸钙
.
(5)实验步骤⑤用蒸发溶剂的方法而不用降低溶液温度的方法获取食盐晶体,原因是
氯化钠的溶解度受温度影响较小
氯化钠的溶解度受温度影响较小
;在蒸发食盐溶液的过程中要使用玻璃棒,作用是
搅拌溶液,避免因局部过热,造成液滴飞溅
搅拌溶液,避免因局部过热,造成液滴飞溅
.
[反思与评价]
(6)有同学认为只需要用氢氧化钠溶液和碳酸钠溶液中任意一种试剂就能将两种可溶性杂质出去,你认为这种方法
不可行
不可行
(选填“可行”或“不可行”),理由是
MgCO3、Ca(OH)2均为微溶物,只用任意一种试剂就会有一种杂质生成微溶物而不能全部除去
MgCO3、Ca(OH)2均为微溶物,只用任意一种试剂就会有一种杂质生成微溶物而不能全部除去
.
(7)有同学认为原实验方案不完善,做出这种评价的依据是
在除去MgCl2和CaCl2的同时,又引入了新的杂质NaOH和Na2CO3
在除去MgCl2和CaCl2的同时,又引入了新的杂质NaOH和Na2CO3
.
[实验方案设计]
(8)为了完善原实验方案,你设计的实验是
向溶液C中逐滴加入稀盐酸至不再产生气泡,滴加酚酞试液时溶液不变色
向溶液C中逐滴加入稀盐酸至不再产生气泡,滴加酚酞试液时溶液不变色
(仅写出补充部分的实验操作和现象)

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案