
(6分)回答以下问题:
⑴应用金属活动性顺序能帮助我们进一步学习金属性质。已知下列各组物质间均能发生置换反应。
A.Fe 和CuSO4 溶液 B.Mg和MnSO4 溶液 C.Mn和FeSO4 溶液
①写出Fe 和CuSO4 溶液反应的化学方程式 。
②在相同条件下,四种金属中能与盐酸反应且最剧烈的是 。
⑵氯化铁能腐蚀铜,工业上常用此原理生产印刷线路板。印刷线路板的生产及废液的处理过程如下:
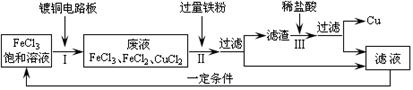
①步骤Ⅱ中发生了两个反应:Fe + 2FeCl3 = 3FeCl2和Fe + CuCl2 = FeCl2 + Cu。滤渣的成分是 ,滤液中的溶质是 。
②步骤Ⅲ中发生反应的化学方程式为 。
③氯化铁能腐蚀铜的原因是(用化学方程式表示) 。
⑴ ① Fe + CuSO4 FeSO4 + Cu ② Mg
⑵ ① Fe和Cu FeCl2
② Fe + 2HCl FeCl2 + H2↑
③ Cu + 2FeCl3 2FeCl2 + CuCl2
【解析】
试题分析:(1)①铁的活动性比铜强,可与硫酸铜溶液反应生成铜和硫酸亚铁,故化学方程式为Fe+CuSO4═FeSO4+Cu;
②由Fe能和CuSO4 溶液反应,得铁比铜强;由Mg能和MnSO4溶液反应,得镁比锰强;由Mn和FeSO4溶液反应,得锰比铁强,故四种金属活动性由强至弱的顺序Mg>Mn>Fe>Cu,则四种金属中能与盐酸反应且最剧烈的金属为Mg。
(2)①向FeCl3、FeCl2、CuCl2的混合溶液中加入过量铁粉,铁粉与FeCl3反应生成FeCl2、与CuCl2反应生成Cu和FeCl2,因此可知过滤所得滤渣中含有剩余的Fe和生成的Cu,滤液中含FeCl2;
②向含有Fe和Cu的滤渣中加入稀盐酸,铁与盐酸反应生成FeCl2和H2,故反应的化学方程式为Fe+2HCl═FeCl2+H2↑;
③印刷线路板的生产中所得废液中含FeCl3、FeCl2、CuCl2,可推断氯化铁能腐蚀铜生成FeCl2与CuCl2,故反应的化学方程式为Cu+2FeCl3 2FeCl2+CuCl2。
考点:金属活动性顺序及其应用,书写化学方程式
点评:熟记金属活动性顺序及其应用,在金属活动性顺序中,位于氢之前的金属能从酸中置换出氢,活动性强的金属能将活动性弱的金属从其盐溶液中置换出来。


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
 下图是实验室中用于制取和收集气体的装置图,请回答以下问题:
下图是实验室中用于制取和收集气体的装置图,请回答以下问题: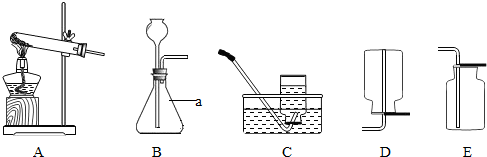
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
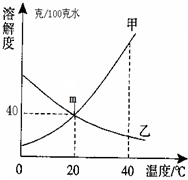 (2010?宝山区一模)甲、乙两种物质的溶解度曲线如图.试回答以下问题:
(2010?宝山区一模)甲、乙两种物质的溶解度曲线如图.试回答以下问题:查看答案和解析>>
科目:初中化学 来源: 题型:058
(2005
年杭州)课外兴趣小组要利用含有 、
、 的混合溶液来制取饱和
的混合溶液来制取饱和 溶液.已知混合溶液有1000g,其中含
溶液.已知混合溶液有1000g,其中含 2.4%、
2.4%、 15%.现有以下可选用试剂:镁片、锌粒、氢氧化钡溶液.请回答以下问题:
15%.现有以下可选用试剂:镁片、锌粒、氢氧化钡溶液.请回答以下问题:
(1)
应往混合溶液中加入足量的上述试剂中的________,然后过滤,即得纯的 溶液.
溶液.
(2)
上述反应后的滤液中有 多少________克?(列式解答,可能用到的相对原子质量:H——1;O——16,Mg——24;S——32;Cu——64;Ba——137;Zn——65)
多少________克?(列式解答,可能用到的相对原子质量:H——1;O——16,Mg——24;S——32;Cu——64;Ba——137;Zn——65)
(3)
往上述滤液中还要加________g ,才能成为20℃时的饱和溶液.
,才能成为20℃时的饱和溶液.
(20
℃时 的溶解度是54.4g)
的溶解度是54.4g)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com