解:(1)过氧化氢制氧气的反应物是过氧化氢,生成物是水和氧气,反应条件是二氧化锰作催化剂,所以反应方程式为:2H
2O
2
2H
2O+O
2↑
(或文字表达式:过氧化氢
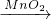
水+氧气);
用过氧化氢制取氧气是固体与液体,不需要加热,所以发生装置是A,氧气不易溶于水且密度比空气大,所以可以用C或D来收集;
①过氧化氢溶液从长颈漏斗口加入,二氧化锰从锥形瓶口加入;
②排空气法和排水法相对来说,排水法收集的气体更纯;
③根据观察到锥形瓶内有大量气泡产生,说明反应产生了氧气;但开始用C装置收集氧气,过一断时间后用带火星的木条伸入瓶口、瓶中、瓶底,都未见木条复燃,说明气体溢出了,装置漏气;
④根据两种方法的反应条件,可知用过氧化氢溶液分解不需要加热,操作就比较简单;产物都不止一种,故选择B;
⑤装置A中反应剧烈,说明可能是反应物浓度太大或滴加速度太快,而分液漏斗可以控制液体滴加的速度;用体积小的锥形瓶不会改变反应速度;加热会加快反应;故选择:A;
(2)①通过下面的收集资料就能判断实验目的是:用氯酸钾制取氧气;
②催化剂所起的作用叫催化作用;反应的方程式为:2KClO
3
2KCl+3O
2↑;
③固体与固体制取气体需要加热,所以发生装置选择B,因为氧气能使带火星的木条复燃,所以用带火星的木条来验满,放到瓶口能复燃说明满了,否则不满.
故答案为:(1)2H
2O
2
2H
2O+O
2↑(或过氧化氢
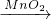
水+氧气);A;C或D;①过氧化氢溶液 二氧化锰; ②C; ③装置漏气;④B;⑤A;
(2)①用加热氯酸钾(KClO
3)和二氧化锰固体混合物制取氧气;②起催化作用;2KClO
3
2KCl+3O
2↑;③B;用带火星的木条放到集气瓶口,看是否熄灭.
分析:(1)过氧化氢在二氧化锰的作用下分解成水和氧气,写出其反应方程式;根据反应物的状态和反应条件选择发生装置;根据气体的密度和溶解性选择收集装置;
①固体一般从锥形瓶口加入,液体从长颈漏斗口加入;②排空气法和排水法相对来说,排水法收集的气体更纯;③装置漏气就收集不到气体;④根据操作的简单性及生成的产物分析;⑤根据分液漏斗的作用分析;
(2)①实验目的要根据下面的步骤去推并模仿(1)来写;②根据催化剂的作用回答;③氯酸钾制氧气需要加热,根据氧气能使带火星的木条复燃的特性来验满.
点评:通过本题学生进一步明确了科学实验的正确步骤,通过分析本题加深了气体收集方法的选取方法,发生装置的选择方法,氧气的验满方法等.

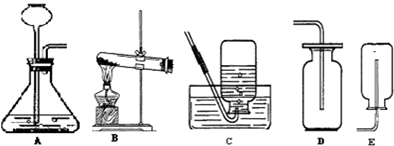
 2H2O+O2↑
2H2O+O2↑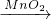 水+氧气);
水+氧气); 2KCl+3O2↑;
2KCl+3O2↑; 2H2O+O2↑(或过氧化氢
2H2O+O2↑(或过氧化氢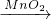 水+氧气);A;C或D;①过氧化氢溶液 二氧化锰; ②C; ③装置漏气;④B;⑤A;
水+氧气);A;C或D;①过氧化氢溶液 二氧化锰; ②C; ③装置漏气;④B;⑤A; 2KCl+3O2↑;③B;用带火星的木条放到集气瓶口,看是否熄灭.
2KCl+3O2↑;③B;用带火星的木条放到集气瓶口,看是否熄灭.
