
| 硝酸铵(NH4NO3)净重:50Kg 含氮量≥31.5% ××化肥厂出品计算: (1)NH4NO3的相对分子质量为 (2)NH4NO3中N、H、O三种元素的质量比为 (3)纯净的NH4NO3中,氮元素的质量分数为 (4)该厂生产的每一袋这种化肥中NH4NO3的质量应不少于 分析:(1)根据相对分子质量等于各个原子的相对原子质量总和,进行解答; (2)物质中各元素的质量比就是相对原子质量乘以原子个数之比; (3)根据物质中某元素的质量分数=该元素的相对原子质量×原子个数该物质的相对分子量×100%,求出理论含氮质量分数, (4)根据混合物中某元素真实含量质量分数除以理论含量质量分数乘以百分之一百就是纯度,进行解答. 解答:解:(1)根据相对分子质量等于各个原子的相对原子质量总和,可得NH4NO3的相对分子质量为=(14×2)+(4×1)+(16×3)=80; (2)NH4NO3中N、H、O三种元素的质量比为:(14×2)+(4×1)+(16×3)=7:1:12; (3)硝酸铵中氮元素质量分数=
(4)此化肥中硝酸铵的纯度=
故答案为:(1)80, (2)7:1:12, (3)35%, (4)45Kg. 点评:本题主要考查学生对化学式表示的意义和物质的纯度的计算方法的理解与应用,要注意计算的格式和结果的准确性.  
练习册系列答案
相关习题
科目:初中化学 来源:2008年江苏省扬州市初中毕业升学统一考试、化学试卷 题型:022 某化式厂为综合利用生产过程中的副产品CaSO4,与相邻的化肥厂联合设计了以下制备(NH4)2SO4的工艺流程: 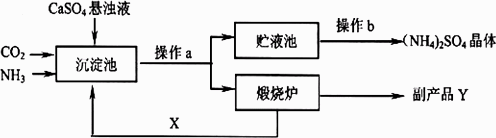
(1)上述流程中,沉淀池中发生的主要化学反应为: CO2+2NH3+CaSO4+H2O=CaCO3+(NH4)2SO4,煅烧炉中发生的化学反应方程式为________.该工艺中可循环使用的X为________(填化学式,下同),副产品Y为________. (2)操作a的名称是________,实验室中进行此操作时,用到的玻璃仪器除玻璃棒、烧杯外,还需要________,请说出该仪器的另一种用途________.操作b的过程是________、冷却、________. 查看答案和解析>> 同步练习册答案 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区 违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com版权声明:本站所有文章,图片来源于网络,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请作者速来函告知,我们将尽快处理,联系qq:3310059649。 ICP备案序号: 沪ICP备07509807号-10 鄂公网安备42018502000812号 |