
分析 (1)氯化钠和碳酸钠都能与硝酸银反应分别生成了氯化银和碳酸银沉淀,碳酸银沉淀能溶于稀硝酸,据此分析回答;
(2)【提出猜想】根据碳酸钠与氯化钙的反应及反应物的量进行猜想;
【实验操作及现象】碳酸钠能与盐酸反应生成了二氧化碳气体.
【实验结论】反应的溶液中含有碳酸钠,说明了碳酸钠没有完全反应,据此分析对计算结果的影响.
解答 解:(1)由于碳酸钠能与硝酸银反应生成了碳酸银沉淀,碳酸银能与稀硝酸反应生成了气体.所以,应该再向溶液中加入适量的稀硝酸溶液,并观察到有气泡生成现象时,才能证明样品不纯净.
(2)【提出猜想】由于碳酸钠与氯化钙的反应生成了碳酸钙沉淀和氯化钠,由反应物质的量不同,反应后的溶液的溶质不同,当碳酸钠过量时有剩余的,所以,猜想③是NaCl和Na2CO3;
由于氯化钙能与碳酸钠反应生成了沉淀,所以猜想④错误
【实验操作及现象】向反应后溶液中加入适量稀盐酸,有气泡产生,说明了含有碳酸钠,说明了含有碳酸钠.
【实验结论】反应的溶液中含有碳酸钠,说明了碳酸钠没有完全反应.实验所得数值比实际数值偏小.
故答为:(1)稀硝酸,有气泡生成.
(2)【提出猜想】由Na2CO3;④;
【实验操作及现象】气泡.
【实验结论】偏小.
点评 本题通过实验探究了碳酸钠的存在、含量等.难度不大,掌握碳酸根离子的检验方法是解答本题的关键.


 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:初中化学 来源: 题型:解答题
| 实验 序号 | 过氧化氢 的质量分数 | 过氧化氢 溶液体积(mL) | 温度 | 二氧化锰 的用量/g | 收集氧气 的体积/ml | 反应所需 的时间/s |
| ① | 5% | 1 | 20 | 0.1 | 4 | 16.75 |
| ② | 15% | 1 | 20 | 0.1 | 4 | 6.04 |
| ③ | 30% | 5 | 35 | 2 | 49.21 | |
| ④ | 30% | 5 | 55 | 2 | 10.76 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 某研究小组在实验室制取二氧化碳的研究中发现,通常不选用大理石与稀硫酸反应制取二氧化碳,其原因是反应生成硫酸钙微溶物覆盖在固体的表面,阻碍了大理石与稀硫酸的接触,反应速率逐渐减慢甚至停止.为此,该小组设立研究课题:选择合适浓度的硫酸和适当的反应温度制取二氧化碳.
某研究小组在实验室制取二氧化碳的研究中发现,通常不选用大理石与稀硫酸反应制取二氧化碳,其原因是反应生成硫酸钙微溶物覆盖在固体的表面,阻碍了大理石与稀硫酸的接触,反应速率逐渐减慢甚至停止.为此,该小组设立研究课题:选择合适浓度的硫酸和适当的反应温度制取二氧化碳.| 试管编号 | 1 | 2 | 3 | 4 | 5 |
| 硫酸浓度(%) | 15 | 20 | 25 | 30 | 35 |
| 气体体积(mL) | 35 | 47 | 55 | 51 | 42 |
| 试管编号 | A | B | C | D | E |
| 温度(℃) | 40 | 50 | 60 | 70 | 80 |
| 现象和 比较 | 有少量气泡 | 气泡比A号试管多 | 气泡明显比B号试管多 | 大量气泡产生,与常温用盐酸反应相似 | 反应激烈,迅速产生大量气体 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
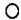 ”、“
”、“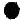 ”分别表示不同元素的原子,下列各项中对图示模型理解正确的是( )
”分别表示不同元素的原子,下列各项中对图示模型理解正确的是( )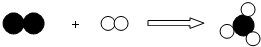
| A. | 该反应属于分解反应 | |
| B. | 反应中共有三种元素参与 | |
| C. | 反应物和生成物中只有一种单质 | |
| D. | 参加反应的两种物质分子个数之比为1:3 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | … |
| 溶解度/g | 96 | 118 | 146 | 183 | 216 | … |

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用工业盐亚硝酸钠烹调食物 | |
| B. | 用煮沸的方法降低水的硬度 | |
| C. | 室内起火时,立即打开所有门窗进行呼救 | |
| D. | 冬天在室内用炭烤火取暖时,关闭门窗 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | “春蚕到死丝方尽,蜡炬成灰泪始干”既涉及物理变化又涉及化学变化 | |
| B. | “众人拾柴火焰高”是指可燃物越多,着火点越低,越容易着火 | |
| C. | “百炼成钢”与“只要功夫深,铁杵磨成针”蕴含的化学原理相同 | |
| D. | “真金不怕火炼”是说黄金熔点很高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com