

分析 根据红褐色沉淀Y为氢氧化铁,而Z为氧化铁,Z与一氧化碳反应生成E铁,白色沉淀W为酸化后的溶液与硝酸银反应生成的沉淀,因此沉淀W为不溶于酸的沉淀,可推断为氯化银,结合反应框图可知,X溶液中含Cl-;而X与NaOH反应Fe(OH)3红褐色沉淀,所以X溶液中含有Fe3+;综上所述,物质X为氯化铁溶液;据此,可根据反应框图完成对其它物质的推断.
解答 解:
根据红褐色沉淀Y为氢氧化铁,而Z为氧化铁,Z与一氧化碳反应生成E铁,白色沉淀W为酸化后的溶液与硝酸银反应生成的沉淀,因此沉淀W为不溶于酸的沉淀,可推断为氯化银,结合反应框图可知,X溶液中含Cl-;而X与NaOH反应Fe(OH)3红褐色沉淀,所以X溶液中含有Fe3+;综上所述,物质X为氯化铁溶液;据此,可根据反应框图完成对其它物质的推断.
(1)根据分析,X溶液中的溶质的成分为氯化铁.
(2)反应①为氯化铁溶液与氢氧化钠反应生成氢氧化铁沉淀和氯化钠,反应的化学方程式为3NaOH+FeCl3═Fe(OH)3↓+3NaCl.
(3)加稀HNO3的作用是除过量的氢氧化钠.
(4)反应③为高温下CO还原氧化铁,生成铁和二氧化碳,故其化学方程式为Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
(5)反应①为氯化铁溶液与氢氧化钠反应生成氢氧化铁沉淀和氯化钠,为复分解反应;
反应②为Fe(OH)3红褐色沉淀加热生成氧化铁和水,为分解反应;
反应③为高温下CO还原氧化铁,生成铁和二氧化碳,不是基本反应类型;
反应④为氯化钠与硝酸银反应生成氯化银沉淀和硝酸钠,为复分解反应.
故上述4个反应中属于复分解反应的是①④.
故答案为:
(1)氯化铁.(2)3NaOH+FeCl3═Fe(OH)3↓+3NaCl.
(3)除过量的氢氧化钠.(4)Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.(5)①④
点评 根据特殊的现象或特殊的反应或特殊的物质颜色,找到推断类题的解决突破口,是解决此类问题的主要手段.


科目:初中化学 来源: 题型:选择题
| A. | 16g | B. | 22g | C. | 44g | D. | 88g |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 | 结论及解释 |
| (1)取少量溶液A于试管中,向其中滴加足量的稀盐酸 | 有气泡产生 | 猜想①不成立 |
| (2)另取少量溶液A于试管中,向其中滴加足量的氯化钙溶液 | 产生白色沉淀 | 反应的化学方程式为Na2CO3+CaCl2=CaCO3↓+2NaCl |
| (3)将步骤(2)所得的混合液静置,向上层清液中滴加无色的酚酞溶液 | 溶液呈红色 | 猜想②成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
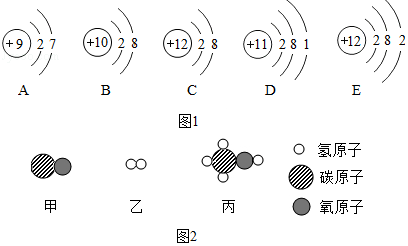
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
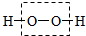 ②H-O-H ③O=C=O ④
②H-O-H ③O=C=O ④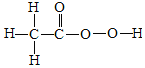
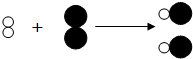
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 某兴趣小组为验证质量守恒定律,除了镁条在空气中燃烧的实验.
某兴趣小组为验证质量守恒定律,除了镁条在空气中燃烧的实验.| 物质 | MgO | MgCl2 | Mg3N2 |
| 颜色 | 白色 | 白色 | 淡黄色 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| 溶解度/g | 21 | 32 | 46 | 64 | 86 | 110 | 138 |


查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com