下列反应都可以制取氢气,写出化学方程式:
(1)水分解________;
(2)锌和稀硫酸反应________;
(3)钠和水在常温下剧烈反应制取氢气,同时生成氢氧化钠________;
(4)化学上利用氢化锂(LiH)和水在常温下反应制取氢气,同时生成氢氧化锂________,在LiH中H的化合价是________;如果用氢化锂和水反应制氢气,现要制取100g氢气,需要氢化锂多少g?
解:(1)水在通电条件下反应生成氢气和氧气.
该反应的化学方程式为:2H
2O

2H
2↑+O
2↑.
(2)锌与稀硫酸反应生成硫酸锌和氢气.
该反应的化学方程式为:Zn+H
2SO
4=ZnSO
4+H
2↑.
(3)钠与水反应生成氢氧化钠和氢气.
该反应的化学方程式为:2Na+2H
2O=2NaOH+H
2↑.
(4)氢化锂与水反应生成氢氧化锂和氢气.
该反应的化学方程式为:LiH+H
2O=LiOH+H
2↑.
设氢化锂中氢的化合价为x.
(+1)+x=0
x=-1
设需要氢化锂的质量为y.
LiH+H
2O=LiOH+H
2↑
8 2
x 100g
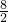
=

,x=400g
故答案为:
(1)2H
2O

2H
2↑+O
2↑;
(2)Zn+H
2SO
4=ZnSO
4+H
2↑;
(3)2Na+2H
2O=2NaOH+H
2↑;
(4)LiH+H
2O=LiOH+H
2↑;
-1价;
需要氢化锂400g.
分析:书写化学方程式时,必须熟悉反应物、生成物和反应条件,必须依据质量守恒定律的两个原则.
化合物中元素的化合价的代数和为零.化合物中锂常显+1价.根据化合价原则和锂的化合价可以计算出氢的化合价.
由生成氢气的质量和氢化锂与水反应的化学方程式可以计算出氢化锂的质量.
点评:本题主要考查化学方程式的书写、化合价的计算和化学方程式的计算,难度较大.

 2H2↑+O2↑.
2H2↑+O2↑.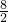 =
= ,x=400g
,x=400g 2H2↑+O2↑;
2H2↑+O2↑;