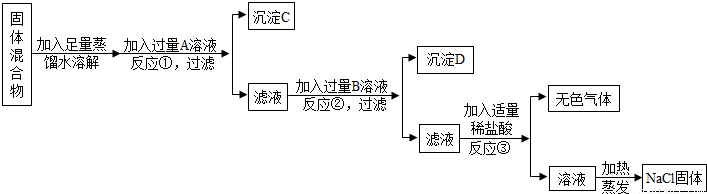
为除去NaCl固体中混有的少量CaCl2.根据下列操作,回答有关问题:
(1)将样品置于烧杯中,加入适量水溶解,同时用玻璃棒搅拌.搅拌的目的是______;
(2)向溶液中加入稍过量的______溶液,发生的化学方程式为______;
(3)过滤.过滤操作中,必须用到的玻璃仪器有______;
(4)向滤液中加入适量的______,其目的______.然后进行蒸发,即可得到纯净的氯化钠固体.
【答案】分析:本题属于除杂质题,一般的除杂质题必须同时满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应②反应时不能加入新的杂质.NaCl固体中混有少量CaCl2,其中氯离子不是杂质,钙离子是杂质,可以用碳酸根离子除去钙离子.加药品时要注意用量,书写化学方程式时要注意配平.过滤中用到的仪器有:烧杯、玻璃棒、漏斗和铁架台.
解答:解:(1)用玻璃棒搅拌是为了加速药品的溶解,故答案为:加速固体的溶解
(2)可以用碳酸钠溶液中的碳酸根离子除去钙离子,碳酸钠溶液要稍过量,目的是把钙离子除干净.故答案为:碳酸钠;CaCl2+Na2CO3=CaCO3↓+2NaCl
(3)烧杯、玻璃棒、漏斗和铁架台中,前三种都是玻璃仪器.故答案为:烧杯、玻璃棒、漏斗
(4)先加入了稍过量的Na2CO3溶液,再向滤液中加入适量的稀盐酸,是为了把碳酸钠除去.故答案为:稀盐酸;除去过量的碳酸钠溶液
点评:本考点属于物质的分离或净化的探究,本题给出了探究的步骤,可以减少难度.根据物质除杂质的条件,要认真分析,综合把握,并加强记忆除去常用离子的方法.还考查了过滤操作的仪器,要加强记忆.本考点经常出现在选择题和实验题中.