
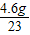 :
: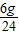 :
: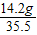 =4:5:8,设Na+的个数是4x,则Mg2+个数是5x,Cl-个数是8x,再设SO42-的个数是y,由溶液中所有的阳离子所带正电荷总数与所有的阴离子所带负电荷总数相等得出4x+5x×2═8x+2y,所以,y=3x,Na+、Mg2+、Cl-、SO42-个数比为4:5:8:3,由 离子的个数关系及质量可以求出SO42-质量.
=4:5:8,设Na+的个数是4x,则Mg2+个数是5x,Cl-个数是8x,再设SO42-的个数是y,由溶液中所有的阳离子所带正电荷总数与所有的阴离子所带负电荷总数相等得出4x+5x×2═8x+2y,所以,y=3x,Na+、Mg2+、Cl-、SO42-个数比为4:5:8:3,由 离子的个数关系及质量可以求出SO42-质量.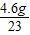 :
: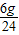 :
: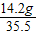 =4:5:8,设Na+的个数是4x,则Mg2+个数是5x,Cl-个数是8x,再设SO42-的个数是y,由溶液中所有的阳离子所带正电荷总数与所有的阴离子所带负电荷总数相等得出4x+5x×2═8x+2y,所以,y=3x,Na+、Mg2+、Cl-、SO42-个数比为4:5:8:3,由Na+、SO42-个数比为4:3,求出Na+、SO42-质量之比为(23×4):(32×3+16×4×3)=23:72,由Na+的质量是4.6克,所以,SO42-的质量是14.4g,所以,A、B、D错误,C正确.
=4:5:8,设Na+的个数是4x,则Mg2+个数是5x,Cl-个数是8x,再设SO42-的个数是y,由溶液中所有的阳离子所带正电荷总数与所有的阴离子所带负电荷总数相等得出4x+5x×2═8x+2y,所以,y=3x,Na+、Mg2+、Cl-、SO42-个数比为4:5:8:3,由Na+、SO42-个数比为4:3,求出Na+、SO42-质量之比为(23×4):(32×3+16×4×3)=23:72,由Na+的质量是4.6克,所以,SO42-的质量是14.4g,所以,A、B、D错误,C正确.

科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
| A、9.6克 | B、28.8克 | C、14.4克 | D、48克 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| A、1:1:2 | B、2:4:7 | C、2:1:2 | D、1:1:10 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
| A.9.6克 | B.28.8克 | C.14.4克 | D.48克 |
查看答案和解析>>
科目:初中化学 来源:2009年天津市中考预测化学试卷(十)(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com