
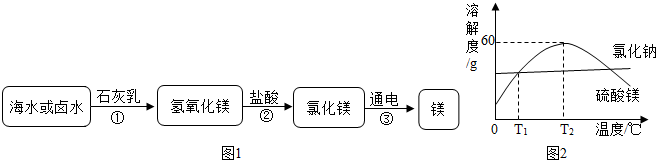
二十一世纪是海洋开发和利用的世纪,我国沿海某市规划确立了“蓝色经济”发展战略,海洋化学资源的综合利用将是重点发展领域之一。以下是某研究性学习小组在探究海水综合利用中遇到的问题,请你参与解决并填空:
问题一:海水制镁过程中如何富集镁离子?甲、乙、丙三位同学各自提出自己的设想:
甲:直接向海水中加入石灰乳。
乙:高温加热蒸发海水后, 加入石灰乳。
加入石灰乳。
丙:向晒盐后的卤水中,加入石灰乳。
通过分析比较,你认为 的设想最为经济合理(选填“甲”、“乙”或“丙”)。
问题二:粗盐纯化过程中如何除去可溶性杂质?
粗盐中含有硫酸钠、氯化钙等杂质。提纯时,先向粗盐水中加过量的氢氧化钡溶液,目的是完全除尽 ;再加过量的 溶液,除去杂质阳离子;滤去沉淀,向滤液中加入  ,将溶液的pH调为7,即得到精盐水。
,将溶液的pH调为7,即得到精盐水。
问题三:海水“制碱”的产物成分是什么?
同学们从某企业取回少量碳酸氢钠受热完全分解后的固体样品,为确定其成分,进行了如下探究。
[提出猜想] 甲的猜想:样品中只含有碳酸钠;
乙的猜想:样品中含有碳酸钠和氢氧化钠;
丙的猜想:样品中只含有氢氧化钠。
他们做出上述三种猜想的依据是 。
[实验记录与分析]
| 步骤 | 实验操作 | 实验现象 | 结论 |
| 1 | 取少量样品于试管中,加水完全溶解,再加入 |
| 丙的猜想不成立 |
| 2 | 取步骤1反应后的溶液于试管中 |
| 只有甲的猜想成立 |
科目:初中化学 来源: 题型:阅读理解
| 步骤 | 实验操作 | 实验现象 | 结论 |
| 1 | 取少量样品于试管中,加水完全溶解,再加入 过量氯化钡溶液 过量氯化钡溶液 |
生成白色沉淀 生成白色沉淀 |
丙的猜想不成立 |
| 2 | 取步骤1反应后的溶液与试管中 滴加无色的酚酞试液 滴加无色的酚酞试液 |
无明显现象 无明显现象 |
只有甲的猜想成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 步骤 | 实验操作 | 实验现象 | 结论 |
| 1 | 取少量样品于试管中,加水完全 溶解,再加入 过量的氯化钙溶液 过量的氯化钙溶液 |
产生白色沉淀 产生白色沉淀 |
丙的猜想 不成立 |
| 2 | 取步骤1反应后的溶液于试管中 滴加酚酞试液 滴加酚酞试液 |
酚酞试液不变色 酚酞试液不变色 |
只有甲的 猜想成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| ||
| ||
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量样品于试管中,滴加 Ca(OH)2溶液 Ca(OH)2溶液 |
生成白色沉淀 生成白色沉淀 |
该氢氧化钠溶液已变质 |
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量样品于试管中,加入足量的 CaCl2 CaCl2 溶液,过滤,在滤液中滴加无色酚酞 无色酚酞 溶液 |
产生白色沉淀 溶液变红 溶液变红 |
该氢氧化钠 部分 部分 变质(填“部分”或“全部”) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com