某烧杯中盛有溶质质量分数为20%的盐酸,向烧杯中放入10.Og石灰石样品(所含杂质不溶于水和酸,也不与水和酸反应),恰好完全反应,实验前烧杯和盐酸质量81.9g,实验后烧杯和杯中物质质量为89.26g.
求:(1)石灰石样品的纯度.
(2)盐酸的质量.
(3)若将反应后所得溶液蒸去5.26g水,冷却到t℃时恰好饱和,求t℃时,该饱和溶液溶质的质量分数.
【答案】
分析:(1)由题中数据知生成二氧化碳的质量为10g+81.9g-89.26g=2.64g,根据题中所要求解的量,分别设出含CaCO
3的质量,盐酸中含HCl质量,生成的CaCl
2质量为,然后根据化学方程式CaCO
3+2HCl═CaCl
2+H
2O+CO
2↑列出三个比例式,分别求出;
(2)根据溶液的质量=

(3)根据题意,求出饱和溶液的质量,以及所含溶质的质量,然后根据公式:溶质的质量分数=
 解答:
解答:解:(1)由题可知,m CO
2=10g+81.9g-89.26g=2.64g
设样品中含CaCO
3的质量为x;盐酸中含HCl质量为y,生成的CaCl
2质量为z,
CaCO
3+2HCl═CaCl
2+H
2O+CO
2↑
100 73 111 44
x y z 2.64g
100:44=x:2.64g
73:44=y:2.64g
11l:44=x:2.64g
解得,x=6.0g,y=4.38g,z=6.66g
石灰石样品纯度
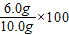
%=60%
(2)盐酸的质量4.38g÷20%=21.9g
(3)反应后所得溶液质量=6+21.9-2.64=25.26g
饱和溶液质量=25.26-5.26=20.0g
CaCl
2的质量分数=
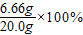
=33.3%
答:该饱和溶液溶质的质量分数为33.3%.
点评:本题是一道综合性的题,考查了溶液与化学方程式相结合的内容,关键是找出里面的已知量,然后根据化学方程式求出未知量,难度较大,需细心解答.



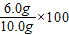 %=60%
%=60%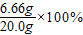 =33.3%
=33.3%

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 水和溶液在生命活动和生产、生活中起着十分重要的作用.
水和溶液在生命活动和生产、生活中起着十分重要的作用.