
【题目】神舟十一号与天宫二号的成功对接增强了国人的民族自信,推动了相关领域的研究。
⑴ 合金材料的研发 ①合金的很多性能与组成它们的纯金属不同。图1能表示锡铅合金的是_________(填序号“a”“b”或“c”)。
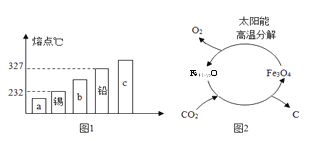
②镁合金被誉为“21世纪绿色金属结构材料”。该合金是一种储氢材料,完全吸氢后得到MgH2和Al,“储氢过程”属于________(填“物理”或“化学”)变化。
⑵ 合成材料的改良:碱式碳酸铝镁[MgaAlb(OH)c(CO3)dxH2O]是一种新型塑料阻燃剂,其中a、b、c、d的代数关系式:2a+3b=_________。
⑶ CO2的绿色利用:①目前空间站处理CO2的一种方法是在催化剂作用下,利用H2使CO2转化为甲烷并得到生活用水。该反应的化学方程式为__________。②以“铁氧化物”为催化剂,利用太阳能将CO2热解为碳和氧气,这一转化过程(如图2)中化合价升高的非金属元素是_________。
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:初中化学 来源: 题型:
【题目】实验室现有氯化镁和硫酸钠的固体混合物样品,小明同学想测定样品中氯化镁的质量分数。先称取该混合物样品20g,完全溶于水中,然后取用了一定溶质质量分数的氢氧化钠溶液100g平均分四次加入其中,充分振荡,实验所得数据见下表,请你分析并进行有关计算:

(1)上表中X的数值为_________;
(2)计算原固体混合物样品中氯化镁的质量分数是_______?(请依据相关化学方程式进行计算,写出必要的过程)
(3)上述实验中所用到的氢氧化钠溶液,是小明同学利用实验室中已有的80g溶质质量分数为30%的氢氧化钠溶液现配制的,试计算需加入______克水,才能配成实验中所需溶质质量分数的氢氧化钠溶液?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】工业上用铁矿石炼铁炼钢和轧制钢材的主要流程如下图
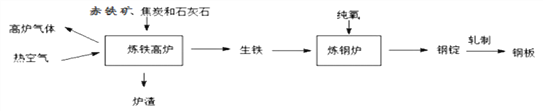
⑴工业炼铁的固体原料需经过粉碎,其目的是_______。
⑵铁高炉中焦炭的作用:①提供高温;②_________(用化学方程式表示);
⑶高炉炼铁原理的化学方程式是_________。是否属于置换反应的_______(填“是”或“否”)。
⑷钢的含碳量为 0.03%-2%,生铁的含碳量为_______。生铁的硬度_______(填“>”、“<”或“=”)纯铁。
⑸生铁炼钢的反应原理是:_______(用化学方程式表示)。将钢锭轧成钢板,体现了金属的______性。
⑹炉渣中含有硅酸钙(CaSiO3),其中硅元素的化合价是___________。
⑺工业上常用稀盐酸除铁锈,写出该反应的化学方程式_______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某兴趣小组在制取氧气的实验过程中,有同学联想到了渔民用过氧化钙(CaO2)增加鱼池中的含氧量,于是做出猜想:过氧化钙与水反应可制取氧气。
实验装置 | 实验主要过程 |
| ①检查装置气密性。 ②加入过氧化钙和水后,有少量细小气泡缓慢放出,在导管口几乎收集不到气体。该装置放置到第二天,集气瓶中只收集到极少量气体,震荡试管后仍有少量细小气泡缓慢放出。 |
实验结论:过氧化钙与水反应_____(填“能”或“不能”)用于实验室制取氧气。
【分析与反思】
(1)小林希望对此实验进行改进,使该反应加快,请你帮他提出合理化建议_____。
(2)同学们对过氧化钙与水反应的生成物猜想如下:①氢氧化钙和氧气②碳酸钙和氧气。你认为猜想_____(填序号)一定是错误的,理由是_____
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】塘沽十五中的学生利用下列实验装置进行氧气和氢气的实验室制取,请根据要求回答:
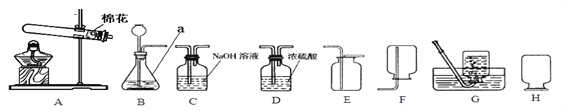
(1)仪器a的名称是______________。
(2)实验室用高锰酸钾制取氧气反应的化学方程式是______________,如用装置A和G进行制取与收集,实验操作有:____________
a.停止加热 b.固定试管 c.将导管从水槽中取出
d.装药品并在试管口处放一小团棉花 e.加热,收集氧气
①d操作在试管口放一小团棉花的原因是_________________。
②上述操作中缺少的一个步骤是_____________,假设该操作步骤为f,则上述制氧气正确的操作顺序是_________(填字母)。
(3)实验室若使用盐酸和金属锌制取氢气,这种方法制得的氢气往往含有少量氯化氢气体和水蒸气,若要得到纯净干燥的氢气,可将气体先通过装置________(填字母),再通过装置________(填字母);集满氢气后的集气瓶按装置H方式放置备用,原因是_____________。反应的化学方程式为______
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】图1是初中化学的几种常用仪器,根据要求回答问题:

(1)写出仪器C的名称________.
(2)实验室用过氧化氢溶液制取氧气,应选用的仪器是_____(填字母序号),反应的化学方程为_____________;若用稀盐酸制取二氧化碳气体,还需要的药品为________________,检验二氧化碳气体已集满的方法是_____________________________________.
(3)小明为了用图2装置收集一定量的氧气,装置接口连接的顺序为____,量筒的作用_____________.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(1)2017年6月2日,国土资源部宣布:我国成为全球海域甲烷水合物试开采连续产气时最长的国家。甲烷水合物俗称可燃冰。可燃冰能效高,非常环保。和煤相比,没有粉尘污染;和石油相比,没有毒气污染;和传统天然气相比,没有其他杂质污染。可燃冰是一种清洁高效的能源.根据材料回答下列问题:
①某种可燃冰的化学式为:CH4·8H2O,该可燃冰中碳元素的质量分数为_______。
②用概括性语言写出可燃冰作为燃料的优点:______________________。
③甲烷完全燃烧的化学方程式为______________________________。
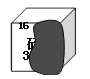
(2)课本后面的元素周期表被墨水沾污,某元素的信息被部分覆盖,如下图,你认为该元素是_____________ (填元素名称)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】研究表明,在同温同压下,相同体积的任何气体中含有的气体分子数相同。在如图所示的密闭容器中有一个理想活塞(滑动自如,且密封性绝对可靠),处在容器体积的![]() 处;其中
处;其中![]() 的部分充的是空气,另
的部分充的是空气,另![]() 的部分充的是H2和O2的混合气体;当后者用电火花点燃引爆时,活塞先被冲到左边;而当容器内的气体逐渐恢复到原来的温度时,活塞渐渐向右边移动,最终停在容器容积的
的部分充的是H2和O2的混合气体;当后者用电火花点燃引爆时,活塞先被冲到左边;而当容器内的气体逐渐恢复到原来的温度时,活塞渐渐向右边移动,最终停在容器容积的![]() 处,则原来的氢气和氧气的体积比可能是
处,则原来的氢气和氧气的体积比可能是
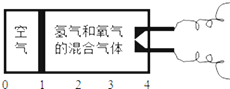
A. 8:1 B. 7:2 C. 4:5 D. 2:7
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】工业废料石膏(CaSO42H2O)可以“变废为宝”,用于生产氧化钙、硫酸钾、电石(化学名称为碳化钙)等。某研究性学习小组展开了如下系列研究。
一、高纯CaO的制备
【资料一】
Ⅰ.石膏(CaSO42H2O)与碳粉高温煅烧生成氧化钙和几种气态非金属氧化物。
Ⅱ.SO2能使品红溶液褪色,也能使澄清石灰水变浑浊。
甲同学用如图1装置制备CaO并验证石膏与焦炭高温反应的其他产物。
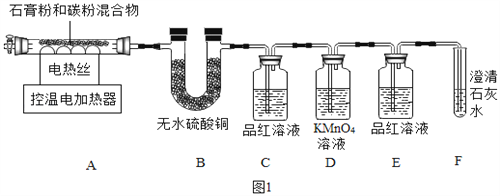
实验过程中发现:B中无水硫酸铜变蓝;C中产生__现象证明有SO2生成;装置__中无明显变化和装置F中__现象证明有CO2生成。写出石膏与碳粉在高温条件下反应的化学方程式:____。
二、硫酸钾和电石的制备
乙同学模拟生产化肥硫酸钾和电石的流程如图2:
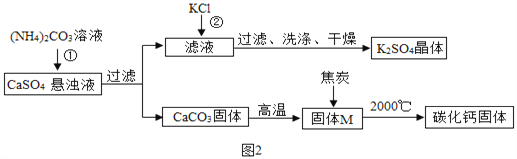
【资料二】CaO与C在高温下反应生成碳化钙(化学式为CaCx)和CO。
(1)反应①的化学方程式为___。证明固体M中不含CaCO3的方法是____(写出实验的方法、现象)。
(2)反应②的化学方程式为(NH4)2SO4+2KCl═K2SO4↓+2NH4Cl,该反应能析出K2SO4晶体的原因是__。
三、假设上述流程中制得的碳化钙(化学式为CaCx)固体中只含杂质CaO,乙小组同学为测定CaCx中x的值进行如下实验。
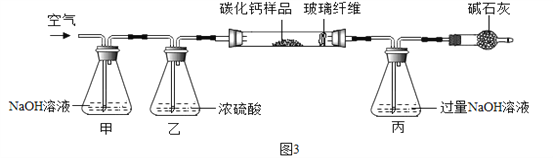
【资料三】CaCx在空气中灼烧生成CaO和CO2。
步骤一:称取3.76g样品于图3所示石英管中(测定装置图如图3,夹持及加热装置省略),反应前缓缓通入空气,高温灼烧石英管中的样品至反应完全后继续缓缓通入空气,测得丙溶液的质量比反应前增重了4.4g。(玻璃纤维可防止固体粉末进入导管)
步骤二:将石英管内剩余固体全部转移到水中,加入足量碳酸钠溶液,经搅拌、过滤、洗涤、干燥等操作得到碳酸钙固体6克。试回答下列问题:
(1)装置甲的作用是__。反应完全后继续缓缓通入空气的目的是__。
(2)根据步骤一、二计算该样品中钙、碳、氧的质量比为___,
计算确定CaCx的化学式(请写出计算过程)______________。
(3)若碳酸钙未能完全干燥,则会导致CaCX中的x的值____(填“偏大”、“偏小”、“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com