
实验室用锌、氧化铜、稀硫酸三种物质,采取两种方法制取铜,现有下列实验装置
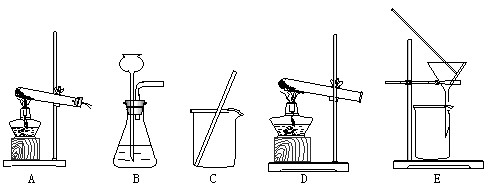
(1)实验过程中有蓝色溶液产生的方法(第1种方法),应选用上述装置中的
(填字母序号,下同)。
反应的化学方程式为 、
(2)另一种方法(第2种方法)应选用上述装置中的 。
反应的化学方程式为 、
(3)用第1种方法制得的铜,其中的杂质可能是 ,可加入 (药品名)除去;
用第2种方法制得的铜,其中的杂质可能是 ,在第2种方法中,为确保实验的安全,必须要检验 。
(4)在实验中玻璃棒的作用分别是 、
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
| ||
| ||
| ||
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com