
归纳是化学学习的重要方法之一,在以下的归纳中你认为是正确或者是错误的,都请你按要求举例证明.
(1)中和反应生成盐和水,但生成盐和水的反应不一定是中和反应.(用化学方程式说明)
.
(2)分解反应就是一种物质生成两种物质的反应.(用化学方程式说明)
.
(3)合金都是由金属元素组成的.(用实例说明)
.
(4)盐溶液一定显中性.(用实例说明)
.
(1)对,CO2+2NaOH═Na2CO3+H2O;
(2)错,2KMnO4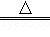 K2MnO4+MnO2+O2 ↑;
K2MnO4+MnO2+O2 ↑;
(3)错,生铁和钢中含有C
(4)错,Na2CO3溶液显碱性.(本题答案仅供参考,其他合理答案合理即可)
解析试题分析:(1)中和反应是酸和碱反应生成盐和水,要素一是酸和碱反应,二是对应生成物为盐和水,两者缺一不可.所以该结论正确.对应的实例有二氧化碳与氢氧化钠或者氢氧化钙等的反应,也可以是酸和金属氧化物(如氧化铜或者是氧化铁等)发生的反应.
(2)分解反应是一种反应物生成多种生成物,而多种生成物既可以是两种也可以是两种以上的.所以该结论不正确.可以举例高锰酸钾的分解或者是铜绿的分解.
(3)合金是金属与金属或者是非金属熔合在一起得到的混合物,所以既可以是含有金属也可以是含有非金属元素.常见的合金不是金属和金属形成的例子有生铁,生铁是铁中含有碳元素的形成的合金.
(4)盐类物质在溶液中由于部分会发生水解,导致可能有的显酸性(如氯化铵),有的显碱性(如碳酸钠).
考点:中和反应及其应用;合金与合金的性质;盐的化学性质;分解反应及其应用.
点评:对于概念辨析性的结论,要抓住概念本身的要素去分析,如中和反应,既要是酸和碱反应,又要生成盐和水,两者必须同时满足.


科目:初中化学 来源: 题型:填空题
化学与生产、生活密切相关。请用下列物质的序号填空。
①氮气;②碳酸氢钠;③二氧化碳;④木炭;⑤氯化钠。
(1)用作焙制糕点的发酵粉的主要成分是 。
(2)放入冰箱中,可消除异味的是 。
(3)可用来制造硝酸的是 。
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
高纯氧化钙是用于电子工业重要的无机化工原料。用硫酸钙浓溶液制备高纯氧化钙的工艺流程如下:
反应池中发生反应的化学方程式为:CO2+2NH3﹒H2O+Ca(NO3)2=2NH4NO3+CaCO3↓+H2O
请回答下列问题:
(1)过滤操作中玻璃棒的作用是 。
(2)过滤后所得沉淀表面可能含有的可溶性杂质有 (写一种即可)。
(3)该工艺流程中可循环使用的物质是 。
(4)冷却需在干燥的环境中进行,否则制得的高纯氧化钙中会混有的杂质是 。
(5)上述流程中的副产物NH4NO3可用作氮肥,氮肥的主要作用是 。
A. 促进植物生长,叶色浓绿
B. 增强作物的抗寒、抗旱能力
C. 增强作物的抗病虫害、和抗倒伏能力
查看答案和解析>>
科目:初中化学 来源: 题型:问答题
为绿化环境并改善空气质量,在城市公路两侧种植了树木。园林工人常在树木上涂刷含有硫黄粉等的石灰浆。这样做的目的是什么?(答一点即可)你还知道氢氧化钙的其它用途吗?(答两点即可)
查看答案和解析>>
科目:初中化学 来源: 题型:问答题
亚硫酸盐的一些性质和碳酸盐的性质类似,如:Na2SO3(亚硫酸钠)溶液呈碱性,BaSO3(亚硫酸钡)是白色难溶于水的固体.工业上常用NaOH来吸收SO2气体.现有吸收SO2一段时间后的NaOH样品,请选用下列试剂:盐酸、稀硫酸、蒸馏水、Ba(OH)2溶液、Ba(NO3)2溶液[已知Ba(NO3)2溶液呈中性〕、pH试纸、石蕊指示剂,仪器自选,设计一个简单的实验判断该样品中NaOH是否反应完全,请完成下列实验步骤;
(1)取少量吸收SO2一段时间后的NaOH样品,用适量蒸馏水完全溶解;
(2)用试管取少量该样品溶液;
(3)往试管中逐滴加入 ,到 时,停止加入;
(4)后续实验的操作是: ,若观察到 ,则NaOH已完全反应.
查看答案和解析>>
科目:初中化学 来源: 题型:问答题
硫酸铜常用作农业杀虫剂,如图是利用含铁废铜料生产硫酸铜的工艺,回答下列问题.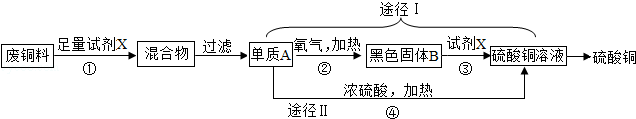
(1)试剂X的化学式是 。
(2)途径Ⅰ中,Cu+2H2SO4 (浓) 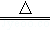 CuSO4+SO2↑+2H2O从环保和经济的角度分析,利用途径 。
CuSO4+SO2↑+2H2O从环保和经济的角度分析,利用途径 。
(填“Ⅰ”或“Ⅱ”)制取硫酸铜更合理;
(3)通常情况下不反应的两种物质,在改变温度和 后,也可能发生反应,如果用足量的铜与20.0溶质质量分数为98.0%的浓硫酸在加热条件下充分反应,实际生成二氧化硫的质量是 (选填字母)。
A.小于6.4g B.等于6.4g C.大于6.4g
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
(8分)同学们在实验室用混合两种固体药品的办法自制“钾、氮复合肥料”,使用到的药品有KCl,K2SO4,NH4HCO3,NH4Cl。同学们制得了成分不同的“钾、氮复合肥料”,从中抽取一份作为样品探究其成分,请回答有关问题:
限选试剂:稀HCl,稀H2SO4,BaCl2溶液,AgNO3溶液,蒸馏水
(1)提出合理假设。所抽样品的成分有4总共可能:
假设1:KCl和 NH4HCO3;假设2:KCl和NH4Cl;
假设3:K2SO4和 NH4HCO3;假设4: 。
(2)形成设计思路。
①甲同学先提出先用AgNO3溶液确定是否含有KCl,你是否同意并说出理由: 。
②乙同学提出先确定是否含有NH4HCO3,则可以选择的试剂是 。
(3)完成实验方案。请填写实验操作,与表中结论相符的预期现象。
| 实验操作 | 预期现象 | 结论 |
| 步骤1: | | 假设2成立 |
| 步骤2: | |
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
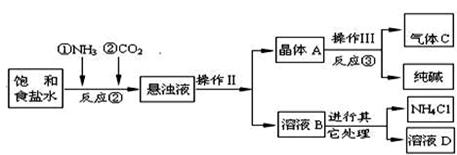
(14分)某校化学兴趣小组欲对食盐的用途进行探究,获得以下信息并对相关问题进行研究。
一、用途之一:作调味品。
食盐的主要成份是NaCl, 通过晾晒海水或煮盐井水、盐湖水等,可以蒸发除去水分得到粗盐.粗盐中含有难溶性杂质(泥沙等)和多种可溶性杂质(氯化镁、氯化钙等).
[提出问题]如何才能将粗盐中难溶性杂质和可溶性杂质(氯化镁、氯化钙)除去,从而获得较纯的食盐晶体?
[资料准备]
| 20℃时,一些物质的溶解度 | ||
| | OH- | CO32- |
| Na+ | 溶 | 溶 |
| Ca2+ | 微 | 不 |
| Mg2+ | 不 | 微 |
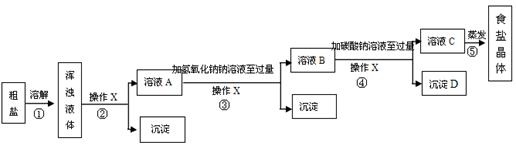
| 物质 | NaCl | NaHCO3 | NH4Cl | NH3 | CO2 |
| 溶解度 | 36.0g | 9.6g | 37.2g | 710 | 0.9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com