



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 ��2013?����������ģ��ij��ѧ��ȤС����ʵ���ҷ�����һƿ��ǩ�ܵ���ʴ����ͼ������Һ�����ǶԴ˲�������Ȥ��
��2013?����������ģ��ij��ѧ��ȤС����ʵ���ҷ�����һƿ��ǩ�ܵ���ʴ����ͼ������Һ�����ǶԴ˲�������Ȥ��| ���� | ʵ����� | ʵ������ | ʵ����� |
| һ | ȡ������Ʒ���Թ��У������μ�BaCl2��Һ������һ��ʱ�䣬��ȥ�ϲ���Һ��������м����μ�ϡ���� | �ȳ��ְ�ɫ������������������� | ��ƿ��ɫ��Һ�� Na2CO3 Na2CO3 �� |
| �� | ȡ��ƿ��Һ�������μ� ���� ���� ��Һ |
�������� | ��ƿ��ɫ��Һ��Na2CO3����Ӧ�Ļ�ѧ����ʽ�� 2HCl+Na2CO3�T2NaCl+CO2��+H2O 2HCl+Na2CO3�T2NaCl+CO2��+H2O �� |
| �� | ȡ������Ʒ���Թ��У������μ�MgSO4��Һ | ���� ��ɫ���� ��ɫ���� |
��ƿ��ɫ��Һ�� Na2CO3�� |
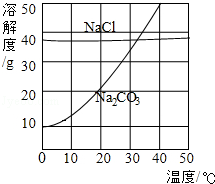
| ���������ϵ�֪������������̼���ơ�̼�����Ƶ���Һ�ʼ��ԣ����������ε���Һ�����ԣ����������һ��ʵ�鷽����ȷ������Һ�����������Σ� | |||
| �� | ȡ������Ʒ���Թ��У��μӵμ�2��3�η�̪ ȡ������Ʒ���Թ��У��μӵμ�2��3�η�̪ |
��Һ��� | ��ƿ��ɫ��Һ�� Na2CO3�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ���� | NaCl | NH4CO3 | NH4Cl | NaHCO3 |
| �ܽ�� | 36.0 | 21.6 | 37.2 | 9.6 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
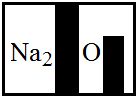 ��2013?����һģ��ij��ѧ��ȤС����ʵ���ҷ�����һƿ��ǩ�ܵ���ʴ����ͼ��ʾ������Һ�����ǶԴ˲�������Ȥ��
��2013?����һģ��ij��ѧ��ȤС����ʵ���ҷ�����һƿ��ǩ�ܵ���ʴ����ͼ��ʾ������Һ�����ǶԴ˲�������Ȥ��| ʵ����� | ʵ������ |
| ��1��ȡ������Ʒ���Թ��У������μ�BaCl2��Һ | ���ְ�ɫ���� |
| ��2������һ��ʱ�����ȥ�ϲ���Һ��������м����μ�ϡ���� | ��ɫ����ȫ���ܽ⣬������������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ���� | NaCl | NH4CO3 | NH4Cl | NaHCO3 |
| �ܽ�� | 36.0 | 21.6 | 37.2 | 9.6 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013�꽭��ʡ������ѧ����ѧУ�п���ѧһģ�Ծ��������棩 ���ͣ������
| ���� | NaCl | NH4CO3 | NH4Cl | NaHCO3 |
| �ܽ�� | 36.0 | 21.6 | 37.2 | 9.6 |

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com