
 (1)2008年初,我国南方地区抗击暴风雪中融雪剂发挥了一定的作用.其中一种融雪效果好、无污染的融雪剂的主要成份是醋酸钾(CH3COOK),该盐对应的酸是醋酸(CH3COOH)
(1)2008年初,我国南方地区抗击暴风雪中融雪剂发挥了一定的作用.其中一种融雪效果好、无污染的融雪剂的主要成份是醋酸钾(CH3COOK),该盐对应的酸是醋酸(CH3COOH)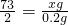


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
 (1)2008年初,我国南方地区抗击暴风雪中融雪剂发挥了一定的作用.其中一种融雪效果好、无污染的融雪剂的主要成份是醋酸钾(CH3COOK),该盐对应的酸是醋酸(CH3COOH)
(1)2008年初,我国南方地区抗击暴风雪中融雪剂发挥了一定的作用.其中一种融雪效果好、无污染的融雪剂的主要成份是醋酸钾(CH3COOK),该盐对应的酸是醋酸(CH3COOH)查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源:南充 题型:问答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com