
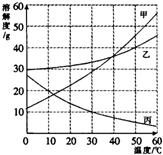
 甲、乙、丙三种物质的溶解度曲线如右图所示.据图回答:
甲、乙、丙三种物质的溶解度曲线如右图所示.据图回答: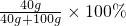 =28.6%;
=28.6%;

 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:初中化学 来源: 题型:
 24、甲.乙.丙三种物质的溶解度曲线如图所示,据图回答:
24、甲.乙.丙三种物质的溶解度曲线如图所示,据图回答:查看答案和解析>>
科目:初中化学 来源: 题型:
 (2008?徐汇区一模)如图是甲、乙、丙三种物质(均不含结晶水)的溶解度曲线.现有t2℃时甲、乙、丙三种物质的饱和溶液(无固体存在),请根据右图回答:
(2008?徐汇区一模)如图是甲、乙、丙三种物质(均不含结晶水)的溶解度曲线.现有t2℃时甲、乙、丙三种物质的饱和溶液(无固体存在),请根据右图回答:查看答案和解析>>
科目:初中化学 来源: 题型:
 (2012?天津)甲、乙、丙三种物质的溶解度曲线如图所示.根据图中信息回答下列问题:
(2012?天津)甲、乙、丙三种物质的溶解度曲线如图所示.根据图中信息回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:
 (2013?武汉)如图是甲、乙、丙三种物质的溶解度曲线.
(2013?武汉)如图是甲、乙、丙三种物质的溶解度曲线.查看答案和解析>>
科目:初中化学 来源: 题型:
 (2013?文昌一模)如图所示是甲、乙、丙三种物质的溶解度曲线,在20℃时,分别取等质量的三种物质的饱和溶液放入三只烧杯中,然后向溶液中分别加入等质量的相应固体物质,再将温度升高到40℃,结果甲物质全部溶解,丙物质部分溶解,试回答下列问题:
(2013?文昌一模)如图所示是甲、乙、丙三种物质的溶解度曲线,在20℃时,分别取等质量的三种物质的饱和溶液放入三只烧杯中,然后向溶液中分别加入等质量的相应固体物质,再将温度升高到40℃,结果甲物质全部溶解,丙物质部分溶解,试回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com