(2003?桂林)将1.5 g混有铜粉的镁粉投入100g稀硫酸中,至不再产生气泡为止,共收集0.1 g气体.过滤后,向所得溶液滴入质量分数为10%的氢氧化钠溶液.开始滴入时无沉淀生成,滴加一定质量的氢氧化钠溶液后开始出现白色沉淀.当滴加氢氧化钠溶液的质量为80g时,恰好得到最多的沉淀量2.9 g.试求:
(1)原混合物中镁的质量分数;
(2)最终所得溶液中溶质的质量分数.(计算结果保留至0.01%)
【答案】
分析:(1)根据金属的活动性可知,铜不能和稀硫酸发生置换反应,故混合物中只有镁能和稀硫酸反应,根据化学方程式得出各物质之间的质量比,列出比例式,通过计算得出镁的质量.然后根据溶质质量分数公式计算即可.
(2)欲正确解答本题,需知接下来会发生哪些化学反应,然后根据化学方程式得出各物质之间的质量比,列出比例式,通过计算得出镁的质量.然后根据溶质质量分数公式计算即可.
解答:解:(1)设原混合物中镁的质量为x,
Mg+H
2S0
4=MgSO
4+H
2↑
24 2
x 0.1g
∴24:2=x:0.1g,
解之得:x=1.2g,
原混合物中镁的质量分数为:
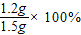
=80%.
(2)首先中和未反应的H
2SO
4,方程式为H
2SO
4+2NaOH=Na
2S0
4+2H
2O,然后再发生如下反应:MgSO
4+2NaOH=Na
2SO
4+Mg(OH)
2↓(即NaOH全部转化为Na
2SO
4)
设最终所得Na
2S0
4的质量为y,
2NaOH~Na
2SO
480 142
80 g×10% y
∴
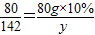
解之得:y=14.2g,
根据质量守恒定律,反应后所得溶液质量为:100g+80g+1.2g-0.1g-2.9g=178.2g,
则最终所得溶液中溶质的质量分数为:
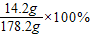
≈7.97%.
答:原混合物中镁的质量分数为80%,最终所得溶液中溶质的质量分数为7.97%.
点评:本题主要考查学生运用化学方程式和溶质质量公式进行计算的能力.

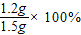 =80%.
=80%.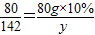
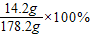 ≈7.97%.
≈7.97%.

 名校课堂系列答案
名校课堂系列答案