

 2NH3;在实验室中可以 用熟石灰和氯化铵混合加热制得氨气,方程式为Ca(OH)2+2NH4Cl
2NH3;在实验室中可以 用熟石灰和氯化铵混合加热制得氨气,方程式为Ca(OH)2+2NH4Cl CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O 4NO+6H2O,硝酸铵不能遇碱性物质混合施用,因为铵根离子与氢氧根离子会结合成氨气,降低肥效,离子方程式为NH4++OH-=NH3+H2O
4NO+6H2O,硝酸铵不能遇碱性物质混合施用,因为铵根离子与氢氧根离子会结合成氨气,降低肥效,离子方程式为NH4++OH-=NH3+H2O 2NH3;Ca(OH)2+2NH4Cl
2NH3;Ca(OH)2+2NH4Cl CaCl2+2NH3↑+2H2O.
CaCl2+2NH3↑+2H2O. 4NO+6H2O;NH4++OH-=NH3+H2O .
4NO+6H2O;NH4++OH-=NH3+H2O .

科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源:2009年山东省济南外国语学校实验班初中升高中保送生化学试卷(解析版) 题型:解答题
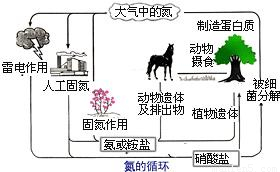
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com