
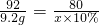


 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:初中化学 来源: 题型:
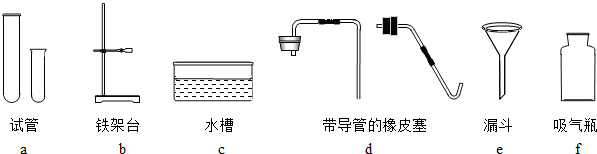
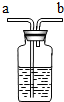 的装置,在装置中盛放大约半瓶蒸馏水,导气管
的装置,在装置中盛放大约半瓶蒸馏水,导气管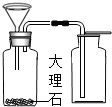 (3)某同学想用图装置制取CO2,组长指出,如果按下图装置,会发生漏气,为解决这一问题,张兵同学选用一种仪器(注意:必须从上图中选择)加在图装置上,解决了漏气的问题.
(3)某同学想用图装置制取CO2,组长指出,如果按下图装置,会发生漏气,为解决这一问题,张兵同学选用一种仪器(注意:必须从上图中选择)加在图装置上,解决了漏气的问题.查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com