
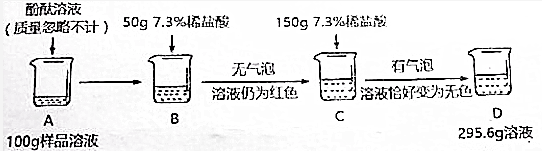
分析 (1)根据溶液稀释前后溶质质量不变进行分析;
(2)根据氢氧化钠和盐酸反应生成氯化钠、水和二氧化碳进行分析;
(3)根据质量守恒定律计算生成二氧化碳的质量,依据化学方程式计算参加反应的碳酸钠的质量进行计算;
(4)根据(3)计算出碳酸钠的质量,然后计算步骤1中加入的盐酸与氢氧化钠、碳酸钠的反应情况进行分析;
(5)根据氯元素守恒,计算生成氯化钠的质量,然后计算溶液的溶质质量分数;
(6)根据步骤2中氢氧化钠、碳酸钠与盐酸反应的化学方程式进行计算.
解答 解:(1)需要质量分数为36.5%的浓盐酸的质量是$\frac{250g×7.3%}{36.5%}$=50g;
(2)B烧杯中加入盐酸后无气泡产生,溶液仍然是红色,所以发生的反应是氢氧化钠和盐酸反应生成氯化钠和水,化学方程式为:NaOH+HCl=NaCl+H2O;
(3)生成二氧化碳的质量为50g+200g-245.6g=4.4g,
设C烧杯溶液中碳酸钠质量为x,消耗盐酸的质量为z
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 73 44
x z 4.4g
$\frac{106}{x}=\frac{44}{4.4g}$,$\frac{73}{z}=\frac{44}{4.4g}$
x=10.6g
z=7.3g
与碳酸钠反应的稀盐酸的质量为$\frac{7.3g}{7.3%}$=100g,
(4)与氢氧化钠反应的稀盐酸的质量为:200g-100g=100g,所以步骤1中加入的50g稀盐酸没有反应完氢氧化钠,所以D烧杯溶液中溶质的化学式为NaCl、NaOH、Na2CO3;
(5)设生成氯化钠的质量为y
HCl----NaCl
36.5 58.5
200g×7.3% y
$\frac{36.5}{200g×7.3%}=\frac{58.5}{y}$
y=23.4g
所以所得不饱和溶液中溶质的质量分数为$\frac{23.4g}{245.6g+50g+4.4g}$×100%=7.8%;
(6)设未变质的氢氧化钠的质量为m
NaOH+HCl=NaCl+H2O
40 36.5
m 100g×7.3%
$\frac{40}{m}=\frac{36.5}{100g×7.3%}$
m=8g
设变质的氢氧化钠质量为n
2NaOH----Na2CO3,
80 106
n 10.6g
$\frac{80}{n}=\frac{106}{10.6g}$
n=8g
所以原氢氧化钠溶液中变质的氢氧化钠与未变质的氢氧化钠质量比为8g:8g=1:1.
故答案为:(1)50g;
(2)NaOH+HCl=NaCl+H2O;
(3)$\frac{106}{x}=\frac{44}{4.4g}$;
(4)NaCl、NaOH、Na2CO3;
(5)7.8%;
(6)1:1.
点评 本题主要考查了化学方程式的计算,难度不大,注意解题的规范性和准确性.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 某同学对硫在氧气中燃烧的实验进行了改进,具体操作:在燃烧匙中放少量的硫粉,点燃后伸入充满氧气的集气瓶,集气瓶底部有较多量的水,观察到实验现象后,回答下列问题:
某同学对硫在氧气中燃烧的实验进行了改进,具体操作:在燃烧匙中放少量的硫粉,点燃后伸入充满氧气的集气瓶,集气瓶底部有较多量的水,观察到实验现象后,回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
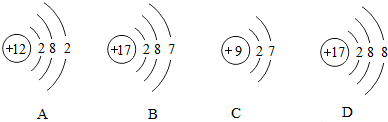
| 第二周期 | 9F 氟 19.00 | 10Ne 氖 20.18 | ||||||
| 第三周期 | 11Na 钠 22.99 | 12_ 镁 24.31 | 13_ 铝 26.98 | 14Si 硅 28.09 | 15p 磷 30.97 | 16s 硫 32.07 | 17_ 氯 35.45 | 18Ar 氩 39.95 |
 .
.
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| A. | 金属资源只是分布在地壳中 | |
| B. | 回收一个铝制易拉罐比制造一个新的要便宜20%,还可以节约金属资源和95%的能源 | |
| C. | 人类可直接利用的淡水资源不到全球总水储量的1% | |
| D. | 太阳能、风能、地热能等的利用,可以部分解决化石燃料面临耗尽的问题 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | K2MnO4 | B. | K2MnO4和MnO2 | ||
| C. | KMnO4和K2MnO4 | D. | KMnO4和K2MnO4和MnO2 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | N2 | B. | CO2和N2 | C. | H2和N2 | D. | CO2和CO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com