(2005?广西)在一定质量的稀硫酸和硫酸铜的混合溶液中,加入足量的金属镁,充分反应后所得溶液的质量与原混合溶液的质量相等,则参加反应的镁的质量(填“大于”、“小于”或“等于”)生成的氢气和铜的质量,原混合溶液中硫酸和硫酸铜的质量比为.
【答案】
分析:由于充分反应后所得溶液的质量与原混合溶液的质量相等,根据质量守恒定律可判断,参加反应镁的质量等于反应后生成氢气和铜的质量;又由于放出氢气的过程使溶液质量增加而产生铜的过程使溶液质量减小,因此增加质量与减小的质量应相等,由此可求得原混合溶液中硫酸和硫酸铜的质量比.
解答:解:根据质量守恒定律,原混合溶液的质量+参加反应镁的质量=反应后溶液的质量+放出氢气质量+生成铜的质量,由于反应后所得溶液的质量与原混合溶液的质量相等,所以参加反应镁的质量=生成的氢气和铜的质量;
设混合溶液中硫酸的质量为m,硫酸铜的质量为n
Mg+H
2SO
4═MgSO
4+H
2↑ 溶液质量增加
98 120 120-98=22
m
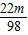
Mg+CuSO
4═MgSO
4+Cu 溶液质量减少
160 120 160-120=40
n
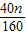
反应前后溶液质量相等,则
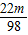
=

,m:n=98:88=49:44
故答案为:等于;98:88(或49:44).
点评:利用差量法解决反应后溶液质量的增加与减少,可使计算过程简捷,解答此类问题时通常采用此方法.

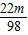
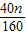
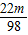 =
= ,m:n=98:88=49:44
,m:n=98:88=49:44

