(本题有a、b两小题,考生任选一题解答,不得两题都解.若两题都解,则以a小题计分.)
a.利用农作物发酵生成的葡萄糖(C6H12O6)进一步分解可以得到乙醇.葡萄糖的相对分子质量为________,其中质量分数最高的元素是________.葡萄糖在酒化酶催化下分解为乙醇和另一种常见气态氧化物,该反应的化学方程式为________.
b.蛋白质是重要的营养物质,它的分子结构可以看成是由多种氨基酸分子间缩去水结合而成,这些氨基酸中有丙氨酸、甘氨酸等.甘氨酸的化学式为H2N-CH2-COOH.请填空:
(1)甘氨酸中碳、氢、氮、氧四种元素的质量比为________;
(2)甘氨酸中碳元素的质量分数为________;
(3)每1g蛋白质完全氧化约放出18kJ的能量,成人每天摄取60-70g的蛋白质,若有10%的蛋白质完全氧化,则放出的能量约为________kJ.
解:a.根据相对分子的质量为组成分子的各原子的相对原子质量之和,可得 葡萄糖的相对分子质量为:12×6+12+16×6=180;
根据化合物中各元素质量比=各元素的相对原子质量×原子个数之比,可得葡萄糖中C,H,O元素质量比为:(12×6):12:(16×6)=72:12:96;
由此可知葡萄糖中质量分数最高的元素是氧元素;
根据质量守恒定律,推断葡萄糖在酒化酶催化下分解为乙醇和另一种常见气态氧化物为二氧化碳;依据书写化学方程式的步骤:写配注等,反应方程式为:C
6H
12O
6
C
2H
5OH+CO
2↑;
故答案为:180;氧(或O);C
6H
12O
6
C
2H
5OH+CO
2↑;H
2N-CH
2-COOH
b.(1)根据化合物中各元素质量比=各元素的相对原子质量×原子个数之比,可得甘氨酸中碳、氢、氮、氧四种元素的质量比为:(12×2):5:14:(16×2)=24:5:14:32;(2)物质中某元素的质量分数=

×100%,可得 甘氨酸中碳元素的质量分数=
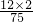
×100%=32%;
(3)放出的能量约为:18kJ×60g×10%=108kJ;18kJ×70g×10%=126kJ;
故答案为:(1)24:5:14:32;
(2)32%;
(3)108~126kJ.
分析:a.根据相对分子的质量为组成分子的各原子的相对原子质量之和,进行解答;化合物中各元素质量比=各元素的相对原子质量×原子个数之比,进行解答;
根据质量守恒定律,推断葡萄糖在酒化酶催化下分解为乙醇和另一种常见气态氧化物为二氧化碳;依据书写化学方程式的步骤:写配注等,写出反应方程式;
b.(1)根据相对分子的质量为组成分子的各原子的相对原子质量之和,进行解答;
(2)物质中某元素的质量分数=

×100%,进行解答;
(3)每1g蛋白质完全氧化约放出的能量与每天摄取的蛋白质的10%的积,即为放出的能量.
点评:本题考查学生书写化学方程式的能力及将质量分数的计算与生活实际相联系;计算时要理清各个量之间的关系,再结合题意进行分析解答.

 C2H5OH+CO2↑;
C2H5OH+CO2↑; C2H5OH+CO2↑;H2N-CH2-COOH
C2H5OH+CO2↑;H2N-CH2-COOH ×100%,可得 甘氨酸中碳元素的质量分数=
×100%,可得 甘氨酸中碳元素的质量分数=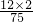 ×100%=32%;
×100%=32%; ×100%,进行解答;
×100%,进行解答;

 33、(本题有a、b两小题,任选一题解答,不得两题都解.若两题都解,则以a小题记分)
33、(本题有a、b两小题,任选一题解答,不得两题都解.若两题都解,则以a小题记分)
 (本题有a、b两小题,考生任选一题解答,不得两题都解.若两题都解,则以a小题计分)
(本题有a、b两小题,考生任选一题解答,不得两题都解.若两题都解,则以a小题计分)