
【题目】我国北方某盐湖生产的纯碱产品中常含有少量的氯化钠(其他杂质忽略不计).为测定该产品中碳酸钠的质量分数,现称取6 g试样放在烧杯中并滴加稀盐酸.当盐酸滴加至36.5 g时,烧杯内溶液的总质量为40.3 g(假设产生的气体全部逸出),产生气体的质量与滴入稀盐酸的质量关系如图所示.试计算:
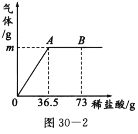
(1)A点产生气体的质量m=___________.
(2)试样中碳酸钠的质量分数_______(结果精确至0.1%).
(3)B点时,烧杯内溶液中的溶质是___________(写出化学式).
【答案】2.2g 88.3% NaCl、HCl
【解析】
(1)根据产生气体的质量与滴入稀盐酸的质量关系图,A点时碳酸钠与盐酸恰好完全反应,之后再加稀盐酸为过量不再发生反应,因此,根据质量守恒定律,利用最终烧杯内溶液总质量与反应前所加各物质总质量的差值,可求得放出二氧化碳质量;
(2)根据反应的化学方程式,由恰好完全反应放出二氧化碳的质量,可计算样品中所含有碳酸钠的质量,该质量与样品质量比可计算试样中碳酸钠的质量分数;
(3)至A点恰好完全反应后,所加稀盐酸过量就不再发生反应,因此,至B点时因盐酸过量,所得溶液为氯化钠和稀盐酸的混合溶液。
根据质量守恒定律,A点产生气体的质量=36.5g+6g-40.3g=2.2g;
故答案为:2.2g;
(2)设样品中碳酸钠的质量为x

样品中碳酸钠的质量分数=![]() ×100%≈88.3%
×100%≈88.3%
即试样中碳酸钠的质量分数为88.3%.
(3)B点时所加稀盐酸过量,所得溶液为氯化钠与稀盐酸的混合溶液,其中溶质为NaCl、HCl;
答案:(1)2.2g(2)试样中碳酸钠的质量分数为88.3%(3)NaCl、HCl。


科目:初中化学 来源: 题型:
【题目】物质王国举行一场趣味篮球赛,某队由铁、二氧化碳、硫酸、氢氧化钙、氯化铜五名“队员”组成,比赛中由氯化铜“队员”发球,“队员”间传球,最后由D位置“队员”投篮进球完成一次有效进攻。场上“队员”位置及传球路线如图所示,图中连线间物质相互反应。则D位置“队员”代表的物质是( )
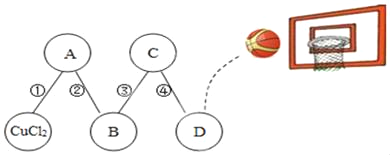
A. 铁B. 二氧化碳C. 硫酸D. 氢氧化钙
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下表为氯化钠、碳酸钠在水中的溶解度。我国西北地区有很多咸水湖,其中最大的是柴达木盆地的察尔汗盐池。某盐湖附近的农民通过“冬天捞碱.夏天晒盐”获得大量湖盐。这里的“碱”指纯碱(主要成分是碳酸钠) ,盐指氯化钠。
温度/℃ | 0 | 10 | 20 | 30 | 40 | |
溶解度 | 氯化钠 | 35.7 | 35.8 | 35.9 | 36.1 | 37.1 |
碳酸钠 | 7.0 | 12.5 | 21.5 | 39.7 | 49.0 | |
(1)请据图表简要解释“冬天捞碱,夏天晒盐”其中的道理____。
(2)小勤同学取该湖盐样品进行探究。
(提出问题)该湖盐样品的成分是什么?
(猜想与假设)猜想一:只有Na2CO3:猜想二:只有NaCl;猜想三:Na2CO3和NaCl。
(实验探究)
实验操作 | 实验现象 | 实验结论 |
取少量样品于试管中,向其中加入足量的____溶液;过滤,得沉淀和滤液,向沉淀中加入足量稀硝酸 | 产生白色沉淀 部分白色沉淀消失 | 猜想三成立 |
(拓展延伸)为进一步确定该湖盐样品中Na2CO3的质量分数,小勤同学再取该湖盐样品10.00g做了如图所示的补充实验(假定每步均完全反应或吸收)。
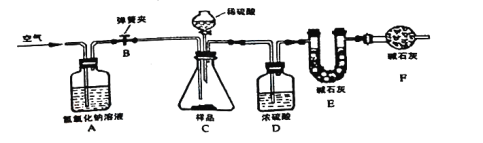
①反应结束之后通入足量空气的目的是_____。
②装置A中氢氧化钠溶液的作用是_____(用化学方程式表示)。
③实验结束后测得装置E增重0.44g,请根据上图所示的实验过程和提供的数据计算该湖盐样品中碳酸钠的质量分数是多少_____?(写出计算步骤,计算结果精确到0.1%)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】用“侯氏制碱法” 制取的纯碱中常常含有少量的氯化钠。为了测定某纯碱样品中碳酸钠的质量分数,小雯同学称取该样品5.6 g加入到烧杯中,再向烧杯中滴加稀盐酸至100 g时,恰好完全反应,称得烧杯中的溶液质量为103.4 g。求:
(1)完全反应产生二氧化碳的质量是__________g。
(2)该纯碱样品中碳酸钠的质量分数____。(结果写成a%的形式,其中a保留一位小数)
(3)100 g稀盐酸溶液中溶质的质量分数_______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我省稀土资源丰富,稀土开采工序中使用的草酸、硫酸铵等产生的大量废水严重污染农业用水和生活用水。某研究性学习小组对此展开了研究。
(查阅资料)a.草酸的化学式为H2C2O4,草酸是一种无色透明的晶体,对人体有害,具有酸的通性:如能与碳酸盐反应产生二氧化碳,能与活泼金属反应等。例如:H2C2O4+Na2CO3=Na2C2O4+CO2↑+H2O;
b.一氧化碳遇到浸有磷钼酸溶液的氯化钯黄色试纸立即变蓝,而CO2遇试纸不变色。回答下列问题:
(1)写出金属铁与草酸反应的化学方程式_______;
(2)硫酸铵在农业上可作化肥使用,在施肥时不能将它与_______混合使用;
(设计方案)草酸加热能分解生成水和气体,研究性学习小组的同学对受热分解生成的气体作如图所示的探究:
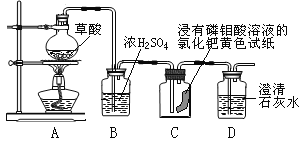
(实验探究)该研究性学习小组同学通过观察实验中的现象,验证猜想。
(现象与结论)请你帮助他们完成报告:
步骤 | 现象 | 结论 |
点燃酒精灯加热,观察现象 | 装置C中:______ 装置D中:_______ | 产生的气体中有CO和CO2 |
(讨论与反思)(1)实验中依据B装置中溶液质量增大,可判断草酸分解生成了 _______;
(2)根据结论,从环保的角度考虑,装置中存在不足之处,改进的方法是_______。
查看答案和解析>>
科目:初中化学 来源: 题型:
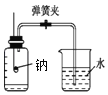
【题目】金属钠是一种银白色的固体,质软,可以用小刀切割。把一小块钠投入水中,它能浮于水面上,并且熔化成一个光亮的小球,那是因为它和水发生剧烈的反应,同时放出热量。钠露置在空气中,很快与空气中的氧气反应生成氧化钠,然而把它在空气中点燃却生成的是一种淡黄色固体过氧化钠(Na2O2)。
(1)上述信息中,属于钠物理性质的是___。(需写出四点)
(2)某同学提出可以用如图所示装置测定空气里氧气的含量。先用弹簧夹夹住橡胶管,点燃钠,伸入瓶中并塞上瓶塞。待钠熄灭后,打开弹簧夹,观察广口瓶内水面的变化情况。
①写出集气瓶中发生反应的化学方程式___。
②实验完毕,该同学发现瓶内水面上升明显大于空气体积的1/5,可能是下列哪些原因___。
A 钠的用量不足
B 瓶塞没有塞紧
C 插入燃烧匙过慢
D 未冷却到室温打开弹簧夹
E 弹簧夹没夹紧,部分气体从导管逸出
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】能源、环境、材料与人类的生活息息相关.根据所学知识回答下列问题,水是生命之源,保护水资源从我做起。
(1)电解水试验中,往水中加入少量氢氧化钠的目的是_____,实验时若正极产生6ml气体,则负极产生气体的体_____ml。
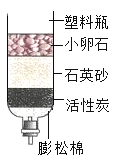
(2)如图所示是常用自制净水器,其中活性炭的作用是_____;制造塑料瓶的材料属于_____材料。我国研制出比漂白粉更高效的饮用水消毒剂“ClO2”,完成制取ClO2的反应的化学方程式:Cl2+2NaClO2=2ClO2+_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列化学反应既是化合反应又是氧化反应的是 ( )
A. 石蜡+氧气![]() 二氧化碳+水B. 水+二氧化碳→碳酸
二氧化碳+水B. 水+二氧化碳→碳酸
C. 一氧化碳+氧气![]() 二氧化碳D. 锌+硫酸→硫酸锌+氢气
二氧化碳D. 锌+硫酸→硫酸锌+氢气
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】镁是初中化学中常见的一种金属。小莫同学欲探究镁的制备方法及镁的一些化学性质。
一、目前世界上60%的镁是从海水提取的。海水提镁的主要流程如下:
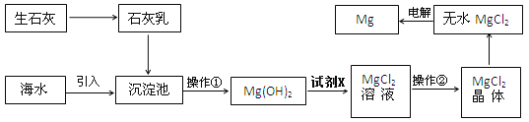
提示:①MgCl2晶体的化学式为MgCl26H2O;
②MgO的熔点为2852℃,无水MgCl2的熔点为714℃.
(1)操作①的名称是 ___________
(2)试剂X的名称_____________
(3)用氯化镁电解生产金属镁的化学方程式为:___________________
(4)工业上是将氢氧化镁转变为氯化镁,再电解熔融氯化镁来制取镁单质;而不采用加热Mg(OH)2得到MgO,再电解熔融MgO的方法制金属镁,其原因是_____________________
二、小莫同学用上述制得的镁与稀盐酸反应。
将打磨后的镁条放入盐酸中,观察到有灰白色沉淀生成的“异常”现象,引起了他的兴趣并进行了以下探究;
(初步探究)出现灰白色沉淀是否为偶然现象
(实验Ⅰ)向4份相同体积与浓度的稀盐酸中加入一定长度的镁带,现象如下:
实验组别 | A | B | C | D |
镁带长度 | 1cm | 3cm | 3cm | 4cm |
沉淀量 | 无沉淀生成 | 少量沉淀 | 沉淀较多 | 沉淀很多 |
(实验结论)并非偶然,据表分析,________________是实验出现“异常”的主要因素;
(再次探究)该沉淀的成分
(猜想假设)猜想1:Mg;猜想2:MgCl2
(实验Ⅱ)
序号 | 实验操作 | 实验现象 | 实验结论 |
① | 取1g样品,加入足量________,振荡 | 未见气泡 | 猜想1错误 |
② | 取1g样品,加入5mL蒸馏水,振荡 | 沉淀未见溶解 | 猜想2错误 |
③ | 取1gMgCl2固体,加5mL蒸馏水,振荡 | 固体全部溶解 |
(交流讨论)
(1)莫凡同学做出猜想1的依据是他认为反应物Mg过量,做出猜想2的依据是他认为生成物MgCl2 _________________________;
(2)从实验设计的角度讲,实验③的作用是_______________;
(深入探究)该沉淀的物质的组成
(查阅资料)
灰白色沉淀的成分为碱式氯化镁,它存在多种组成,化学式可表示为Mgx(OH)yClxnH2O,它受热分解可以产生氧化镁,氯化氢和水;
(实验Ⅲ)
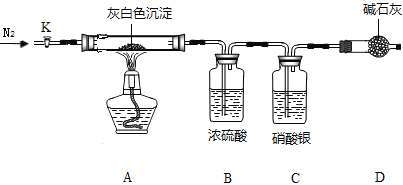
洗去沉淀表面杂质并室温晾干,取其7.07g,用如图装置(夹持仪器未画出)按照正确的操作步骤进行实验,待反应停止后,测得硬质玻璃管中剩余固体质量为4.00g,装置B的质量增加了2.34g;
(问题讨论)
(1)反应停止后,应继续通入氮气一段时间,目的_______________________________;
(2)该沉淀中镁、氯离子个数比n(Mg2+) : n(Cl-) =______________;(写出计算步骤)
(3)若该沉淀Mgx(OH)yClxnH2O中,n=5,则x、y、z的比值为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com