
【题目】氧化锌为白色粉末,无臭、无味,广泛应用于橡胶、涂料、陶瓷、化工、医药、玻璃和电子等行业,为了变废为宝,综合应用资源,经常从锌冶炼、锌制品加工企业回收的废渣(含有ZnO、FeO、Fe2O3、CuO等杂质)来制取氧化锌,其流程如下图所示:
信息:1、3FeO+10HNO3=3Fe(NO3)3+NO+5H2O,NO有毒,能与氧气和水反应生成硝酸。 2、在“除杂Ⅰ”步骤中,只有铁离子能形成氢氧化铁沉淀。
回答下列问题
(1)在酸浸过程中,经常要保持酸过量,理由是;通入空气的目的是:①起搅拌作用,使反应充分,②。通入空气反应的化学方程式为。
(2)在“除杂Ⅰ”步骤中,加入一种金属氧化物与过量的硝酸反应,使溶液pH升高为4左右,请结合本厂实际,可加入的物质是
A.ZnO
B.FeO
C.Fe2O3
D.CuO
(3)为了使产品更加纯净,在“除杂Ⅱ”步骤中,滤渣的成分是。
(4)在“碳化合成”中,生成的产物之一为碱式碳酸锌[Zn2(OH)2CO3],还生成一种能使澄清石灰水变浑浊的气体氧化物。请写出碳化合成步骤的化学方程式。
【答案】
(1)使废渣完全反应,使NO转化为硝酸,4NO+3O2+2H2O=4HNO3
(2)A
(3)Zn、Cu
(4)Zn(NO3)2+2 Na2CO3+H2O= Zn2(OH)2CO3+4NaNO3+CO2↑
【解析】(1)锌渣中加入硝酸将其溶解和氧化,转化为Zn2+、Fe3+、Cu2+、Fe2+,鼓入空气①可以起到搅拌的作用,让其充分反应,然后通过过滤,除去不溶性杂质;②NO有毒,能与氧气和水反应生成硝酸。将有毒气体转化成酸,减少污染物的排放,反应方程式为:4NO+3O2+2H2O=4HNO3
(2)A、 ZnO B、 FeO C、Fe2O3 D、CuO,四种物质都能与硝酸反应生成硝酸盐和水,使溶液的溶液pH升高为4左右,由于本厂的目的是生产氧化锌,所以应选用ZnO,不引入杂质;
(3)为了使产品更加纯净,在“除杂Ⅱ”步骤中,应加入过量的锌,将铜、铁完全从溶液中置换出来,滤渣的成分是锌、铁、铜;
(4)据质量守恒定律可知反应前后元素的种类不变,“碳化合成”中,生成的产物之一为碱式碳酸锌[Zn2(OH)2CO3],有氢元素,所以反应物中还有水,能使澄清石灰水变浑浊的气体氧化物为二氧化碳,所以依据质量守恒定律可得方程式为:2Zn(NO3)2+2 Na2CO3+H2O= Zn2(OH)2CO3+4NaNO3+CO2↑.
所以答案是:(1)使废渣完全反应;使NO转化为硝酸;4NO+3O2+2H2O═4HNO3;
(2)A;
(3)Zn Cu;
(4)2Zn(NO3)2+2 Na2CO3+H2O═Zn2(OH)2CO3+4NaNO3+CO2↑.
【考点精析】掌握金属材料的选择依据是解答本题的根本,需要知道黑色金属:通常指铁、锰、铬及它们的合金.重金属:如铜、锌、铅等;有色金属轻金属:如钠、镁、铝等;有色金属:通常是指除黑色金属以外的其他金属.


科目:初中化学 来源: 题型:
【题目】著名化学家侯德榜的“侯氏制碱法”对传统的纯碱生产技术进行了大胆革新,成为当时世界上最先进的制碱法,纯碱是重要的化工产品,用途很广泛.现以纯碱、石灰石、水三种物质为原料制取氢氧化钠,所发生的化学反应中不包括( )
A.化合反应
B.分解反应
C.置换反应
D.复分解反应
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
A.表示向稀盐酸中不断加水 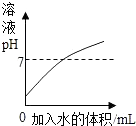
B.表示探究过氧化氢制氧气的反应中二氧化锰的作用 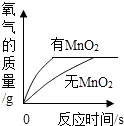
C.表示向盐酸和氯化镁的混合溶液中滴加氢氧化钠溶液 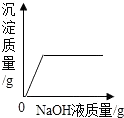
D.20℃时.向一定量的接近饱和的硝酸钾溶液中加人硝酸钾固体 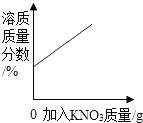
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】一般情况下,正常成年人每次吸入的空气体积约为1L,每分钟呼吸15次,则:
(1)一个成年人每小时吸入空气的体积是多少升?_____
(2)一个成年人每小时吸入空气中氧气的体积约占多少升?_____(最后结果保留整数,已知空气成分按体积计算,氧气为21%)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学就在我们身边,它与我们的生活息息相关。
(1)现有H、O、C、S四种元素,请选用其中的元素写出符合下列要求的物质各一个(用化学式表示):
①具有可燃性的气体;②人体中最多的物质是;
③含氧量最高的氧化物;④污染空气的有害气体。
(2)图1是某陨石样品中各种元素含量的比例图: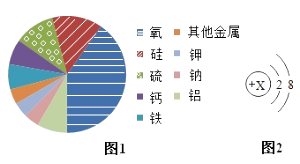
①该陨石中含种非金属元素,
其中含有量最多的是元素;
②钠离子的结构示意图如图2,则X=;
③此陨石样品中不可能含有的化合物是。
A.CaCO3 B.K2SO4
C.Al2O3 D.SiO2
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列对实验现象的描述,正确的是( )
A.红磷燃烧时,会产生大量的白色烟雾
B.铁丝在空气中能剧烈燃烧,火星四射
C.木炭在氧气中燃烧,发出白光
D.硫在空气中燃烧时,会发出蓝紫色火焰
查看答案和解析>>
科目:初中化学 来源: 题型:
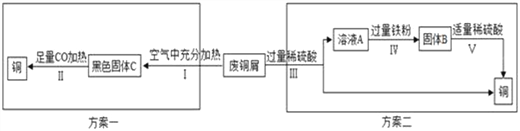
【题目】铜是生活中常见的金属.让我们化学兴趣小组一起探究:久置的铜制品表面能生成 Cu2(OH)2CO3.甲组同学以锈蚀严重的废铜屑为原料(假设不含其他杂质)制取纯铜.如图是兴趣小组设计的两种回收铜的实验方案:
【查阅资料】Cu2(OH)2CO3+2H2SO4═2CuSO4+3H2O+CO2↑
【分析评价】
(1)黑色固体C是_________
(2)步骤Ⅱ的化学反应方程式_________________
(3)步骤Ⅲ、Ⅳ、Ⅴ都需要进行的实验操作是_________,需要用到的玻璃仪器有烧杯、玻璃棒、_________,玻璃棒的作用是__________
(4)步骤Ⅴ过程发生反应的化学方程式为_____________________.
(5)同一份废铜屑分别通过上述两种方案最终得到的铜的质量:方案一_____(填“>”或“=”或“<”)方案二。两种方案中,方案二优越于方案一,理由是______(答一点)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com