



 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:初中化学 来源: 题型:阅读理解
| 高温 |
| 光 |
| 光 |
| 光 |
| 光 |
| H2O |
| △ |
查看答案和解析>>
科目:初中化学 来源:北京市房山区2011年中考一模化学试题 题型:058
金属在生产生活中应用广泛.
(1)每年因金属锈蚀造成很大浪费,铁生锈的条件是________;废钢铁可回收重新冶炼,用一氧化碳还原氧化铁的化学方程式为________;
(2)兴趣小组的同学从实验室中收集一桶含有FeSO4、CuSO4的废液.他们想从中回收金属铜和硫酸亚铁晶体,设计了如下方案:

①写出Ⅰ中有关反应的化学方程式________.
②小红、小强同学在步骤Ⅰ中X能否改用锌的问题上产生了分歧.请你也参与他们的讨论,表明观点,并说明理由________.
(3)某工厂为防止环境污染和回收金属,向含有
AgNO3和Cu(NO3)2的废液中加入一定量的铁粉,充分反应后过滤,向滤渣中加入稀盐酸,无气泡产生.根据上述现象,能得出的结论是________(填序号).A.
滤渣中一定没有FeB.
滤渣中一定有Ag,可能有CuC.
滤液中一定有Fe(NO3)2,一定没有AgNO3D.
滤液中一定有Fe(NO3)2和Cu(NO3)2查看答案和解析>>
科目:初中化学 来源:2013-2014学年北京市西城区九年级上学期期末考试化学试卷(解析版) 题型:选择题
下列实验方案中,能达到实验目的的是
选项 实验目的 实验方案
A 除去混入CO2 中的O2 通过炽热的木炭层
B 确认粉末中含有MnO2 和 CuO 加入过量的过氧化氢溶液
C 从CaCO3 和CaO的混合粉末中得到CaCO3 加入足量的稀盐酸,过滤
D 从AgNO3 和Zn(NO3)2的混合溶液中得到Ag 加入少量的铜粉,过滤
查看答案和解析>>
科目:初中化学 来源:2011-2012学年云南省蒙自市博通总校初三化学综合复习化学试卷 题型:简答题
天然气的主要成分是甲烷(CH4),甲烷不仅是一种很好的燃料,而且是一种重要的化工原料。请你根据下列信息回答问题:
(1)甲烷在高温下可以分解为炭黑和氢气,炭黑可用来制造高级油墨。甲烷分解的化学方程式为:CH4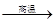 C+2H2,进行该反应必须使甲烷处于特别的环境中,你认为此处所指的特别环境是
。 (2)甲烷与氯气(C12)混合后在光照下可以发生下列反应:CH4+Cl2
C+2H2,进行该反应必须使甲烷处于特别的环境中,你认为此处所指的特别环境是
。 (2)甲烷与氯气(C12)混合后在光照下可以发生下列反应:CH4+Cl2 CH3Cl+HCl
CH3C1+Cl2
CH3Cl+HCl
CH3C1+Cl2 CH2Cl2+HCl CH2Cl2+Cl2
CH2Cl2+HCl CH2Cl2+Cl2 CHCl3+HCl
CHCl3+Cl2
CHCl3+HCl
CHCl3+Cl2 CCl4+HCl
CCl4+HCl
常温下,CH3Cl是气体,CH2Cl2、CHCl3、CCl4都是液体。CCl4可用于灭火,其原因是 (选填下列选项的序号)。
A.CCl4是液体 B.CCl4含有Cl元素 C.CCl4中碳元素已经是最高的+4价,最稳定 D.CCl4的相对分子质量最大
(3)把CH3Cl缓慢通入被加热的烧碱溶液中,发生的反应为:CH3Cl+NaOH CH3-OH
CH3-OH
+NaCl+H2O。为了验证该反应的存在,某化学兴趣小组的同学做了下列实验:
①把一定量的CH3Cl缓慢通入被稀硝酸酸化的AgNO3溶液中,无白色沉淀产生,CH3C1全部从溶液中逸出。②把—定量CH3Cl缓慢通入被加热的烧碱溶液中,有少部分CH3Cl从溶液中逸出。一段时间后停止加热,待溶液温度降到接近室温后,取少量反应后的混合液于另一试管中,滴加稀硝酸至溶液呈酸性,再滴入AgNO3溶液,发现有白色沉淀产生。
该实验第①步的目的是 ,该实验现象说明了什么? 。
实验②中,滴加稀硝酸至溶液呈酸性的原因是
。
查看答案和解析>>
科目:初中化学 来源:2010-2011学年湖北省初三5月供题化学试卷 题型:实验探究题
金属在生产生活中应用广泛。
(1)每年因金属锈蚀造成很大浪费,铁生锈的条件是__________;废钢铁可回收重新冶炼,用一氧化碳还原氧化铁的化学方程式为________________;
(2)兴趣小组的同学从实验室中收集一桶含有FeSO4、CuSO4的废液。他们想从中回收金属铜和硫酸亚铁晶体,设计了如下方案:

①写出Ⅰ中有关反应的化学方程式 。
②小红、小强同学在步骤Ⅰ中X能否改用锌的问题上产生了分歧。请你也参与他们的讨论,表明观点,并说明理由 。
(3)某工厂为防止环境污染和回收金属,向含有AgNO3和Cu(NO3)2的废液中加入一定量的铁粉,充分反应后过滤,向滤渣中加入稀盐酸,无气泡产生。根据上述现象,能得出的结论是 (填序号)。
A.滤渣中一定没有Fe B.滤渣中一定有Ag,可能有Cu
C.滤液中一定有Fe(NO3)2,一定没有AgNO3 D.滤液中一定有Fe(NO3)2和Cu(NO3)2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com