
| A. | NO | B. | N2 | C. | NO2 | D. | N2O |
分析 由质量守恒定律:反应前后,原子种类、数目均不变,据此由反应的化学方程式推断生成物X的化学式.
解答 解:由质量守恒定律:反应前后,原子种类、数目均不变,由反应的化学方程式4NH3+3O2$\frac{\underline{\;一定条件\;}}{\;}$2X+6H2O,反应前氮、氢、氧原子个数分别为4、12、6,反应后的生成物中氮、氢、氧原子个数分别为0、12、6,根据反应前后原子种类、数目不变,则2X分子中含有6个氮原子,则每个X分子由2个氮原子构成,则物质X的化学式为N2.
故选:B.
点评 本题难度不大,利用化学反应前后原子守恒来确定物质的化学式是正确解答此类题的关键.


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:实验探究题
| 实验编号 | 硫酸的质量分数(均取200mL) | 锌的颗粒大小(均取1g) | 氢气的体积(mL)(均收集3分钟) |
| ① | 20% | 锌粒 | 31.7 |
| ② | 20% | 锌粉 | 50.9 |
| ③ | 30% | 锌粒 | 61.7 |
| ④ | 30% | 锌粉 | 75.4 |
| 时段(均为1分钟) | 第1分钟 | 第2分钟 | 第3分钟 | 第4分钟 | 第5分钟 | 第6分钟 |
| 氢气的体积 | 3.1mL | 16.7mL | 11.9mL | 9.6mL | 7.6mL | 6.0mL |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
 现有铁、石灰水、硝酸钡溶液、碳酸钠溶液、稀盐酸五种物质,这五种物质分别是图中A、B、C、D、E中的一种物质,它们间的连线表明相邻的两种物质之间能发生化学反应.
现有铁、石灰水、硝酸钡溶液、碳酸钠溶液、稀盐酸五种物质,这五种物质分别是图中A、B、C、D、E中的一种物质,它们间的连线表明相邻的两种物质之间能发生化学反应.查看答案和解析>>
科目:初中化学 来源: 题型:推断题
 已知A、B、C、D四种物质中含有相同的金属元素,A为红棕色固体.C、D中含元素种类相同,E与C、D属于同一类另的物质,B→A反应过程较为复杂.“→”表示一种物质转化成另一种物质,五种物质的转化关系如下:(1)C物质的化学式是FeCl3.
已知A、B、C、D四种物质中含有相同的金属元素,A为红棕色固体.C、D中含元素种类相同,E与C、D属于同一类另的物质,B→A反应过程较为复杂.“→”表示一种物质转化成另一种物质,五种物质的转化关系如下:(1)C物质的化学式是FeCl3.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 化学就在我们身边.
化学就在我们身边.
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
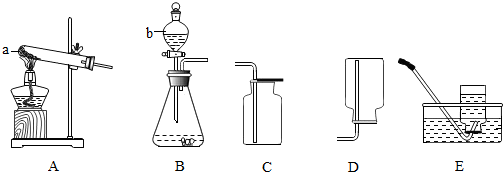
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
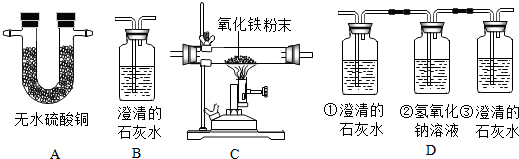
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
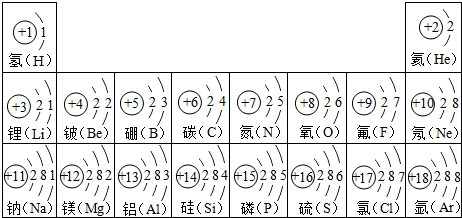
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com