某学生在实验室里分析一种由碳酸钠和氢氧化钠组成的混合物.他先称取m g此混合物倒入某容器,然后加入245g 10%的稀硫酸,结果恰好完全反应,反应后所得溶液的质量比反应物的总质量减少8.8g,求:
(1)产生二氧化碳气体的质量______;
(2)该混合物的组成和m值;
(3)反应后所得溶液的溶质质量分数.
解:(1)从物质之间的反应可知反应后所得溶液的质量比反应物的总质量减少8.8g即是生成的二氧化碳的质量;
(2)设m克混合物中含有碳酸钠的质量为X,能反应掉硫酸的质量是Y,生成硫酸钠的质量是W
Na
2CO
3+H
2SO
4=Na
2SO
4+CO
2↑+H
2O
106 98 142 44
X Y W 8.8g
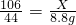
;
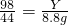
;
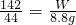
解得
X=21.2g
Y=19.6g
W=28.4g
则245g 10%的稀硫酸中与氢氧化钠反应的硫酸=245×10%-19.6=4.9g
设混合物中氢氧化钠质量为Z,反应生成的硫酸钠质量为N
2NaOH+H
2SO
4=Na
2SO
4+2H
2O
80 98 144
Z 4.9g N
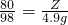
;

Z=4g
N=7.2g
于是m=21.2g+4g=25.2g
该混合物的由碳酸钠和氢氧化钠组成,m值为25.2.
所得溶液的质量是25.2g+245g-8.8g=261.4g.
所得溶液的质量分数为:

×100%≈13.7%
故答案为:(1)8.8;(2)该混合物的由碳酸钠和氢氧化钠组成,m值为25.2.(3)反应后所得溶液的溶质质量分数为13.7%.
分析:依据物质之间的反应分析,氢氧化钠能与硫酸反应生成硫酸钠和水,碳酸钠能与稀硫酸反应生成二氧化碳,由于二氧化碳会跑到空气中,所以溶液的质量比原来反应物的质量减小了,以此为突破口对该问题进行分析探讨即可;
点评:此题是一道依据方程式进行的化学计算综合题,解题的关键是能够依据溶液反应前后的质量变化分析出二氧化碳的质量;

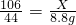 ;
;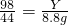 ;
;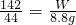
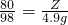 ;
;
 ×100%≈13.7%
×100%≈13.7%

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案