
����Ŀ�������Ũ�Ȳ�ͬ����ѧ���ʻ��кܴ���졣��65 gп���뵽150 g��������Ϊ98%��Ũ�����У�����п���ܽ⣬�����д̼�����ζ�����壬���������γ��������Ҫ���塣���ŷ�Ӧ���Ͻ��У�����Ũ�ȱ�С�����ϡ���ᣬ��ʱ����������û�д̼�����ζ������п������ǡ����ȫ��Ӧ��ʣ�����Һֻ����һ�����ʡ�
(1)��д��п��ϡ���ᷴӦ�Ļ�ѧ����ʽ_______��п��Ũ���ᷴӦ�Ļ�ѧ����ʽ_______��
(2)���ɵ�������������________g��
���𰸡� Zn��H2SO4 (ϡ)=== ZnSO4��H2�� Zn��2H2SO4(Ũ)=== ZnSO4��SO2����2H2O 33
��������(1)���ݸ�������Ϣ��п��Ũ�������ɶ�������ϡ��������������п��ϡ���ᷴӦ�Ļ�ѧ����ʽΪ Zn+H2SO4=ZnSO4+H2����п��Ũ���ᷴӦ�Ļ�ѧ����ʽΪ��Zn+2H2SO4��Ũ��=ZnSO4+2H2O+SO2����(2)150g��������Ϊ98%��Ũ�����к����������Ϊ150g��98%=147g������Ũ���ᷴӦ��п������Ϊx�����ĵ����������Ϊy��
Zn+2H2SO4��Ũ��=ZnSO4+2H2O+SO2��
65 196
x y
![]()
y=![]()
Zn+H2SO4=ZnSO4+H2��
65 98
65g-x 147g-y
![]()
�������Ͽɵ�x=32.5g
��п��һ���Ũ���ᷴӦ��һ���ϡ���ᷴӦ��
�����ɵĶ������������Ϊa�����ɵ�����������Ϊb��
Zn+2H2SO4��Ũ��=ZnSO4+2H2O+SO2��
65 64
32.5g a
![]()
a=32g
Zn+H2SO4=ZnSO4+H2��
65 2
32.5g b
![]()
b=1g
���ɵ����������Ϊ32g+1g=33g��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Դ��������������������ᷢչ������ء�
��1��Ŀǰ�������Ի�ʯȼ��Ϊ��Ҫ��Դ�������Ļ�ʯȼ�ϰ���ú��ʯ�ͺ� ��
��2��Ϊ������Ⱦ�����ú�������ʣ��ɽ���ת��Ϊ��ȼ�����壬�˹��̿���Ϊ��̼��ˮ�ķ�Ӧ������ʾ��ͼ������ʾ��

�÷�Ӧ������ķ��Ӹ�����Ϊ ��
��3��Ϊ�������������ŷţ����ǻ���Ѱ�Ҳ���̼Ԫ�ص�ȼ�ϡ����о�����NH3ȼ�յIJ���û����Ⱦ�����ͷŴ�����������һ��Ӧ��ǰ����
�� NH3�е�Ԫ�غ���Ԫ�ص�������Ϊ ��
�� ��NH3ȼ�շ�Ӧ�Ļ�ѧ����ʽ����������4NH3 + 3O2 ��ȼ 6H2O + ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������С��ͬѧ����ͼA��ͼB��ʾװ����֤̼���Ƶ����ʡ�

��1������ͼAװ�ý�������ʵ��
����һ��������ƿ�ڵ�̼������Һ�еμӷ�̪����Һ�Ժ�ɫ��
���������ע����1����ͷ��ƿ���ƽ���ʹ��ͷ�¶˽���ƿ��Һ���£�������ע��������ʱע����1�з�Ӧ�Ļ�ѧ����ʽΪ �����������������ͷ��������ͼʾ��ʾλ�á�
����������֤̼������̼���Σ�Ӧ�ý��е�ʵ������� ��������ʵ�������� ��
��2������ͼBװ�ý���ʵ�顣��������̼����ͨ�뱥��̼������Һ�У�������ӦΪ��Na2CO3 + CO2 + H2O = 2NaHCO3�����������ǵ�ԭ���dz���Ӧ����ˮʹ�ܼ��������⣬���е�����ԭ���� ���������±���Ϣ�ش𣩡�
���� | 20��ʱ�ܽ��/g | ��Է������� |
Na2CO3 | 21.5 | 106 |
NaHCO3 | 9.6 | 84 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���г����۵ij�����ˮ����ȼ����ˮ����̫������ˮ����
(1)���������õ�ȼ����ˮ����Ҫ����Ȼ��Ϊȼ�ϡ���Ȼ����ȫȼ�յĻ�ѧ����ʽ��__________��ȼ����ˮ��ʹ��ͭ����Ϊ�Ƚ�����������Ҫ����ͭ����_________�ԣ�
(2)̫������ˮ����ȼ��(��Ȼ��)��ˮ����ȣ��ڻ�������������ͻ�����ŵ���___________��
(3)̫������ˮ���ļ�����չ�һ��Ϊ����貣���Ƴɡ���������_______________��
A.������ B.�л��ϳɲ��� C.���ϲ���
(4)��ͼ����Ԫ�����ڱ��е���Ϣ��������5����ʾ�ĺ�����_________________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȡ����Ķ�����̼���壬����֤������̼����������������Һ���Է�����ѧ��Ӧ���������̽��ʵ�顣
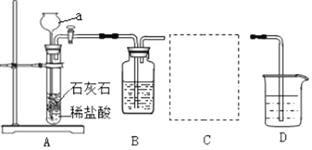
���������ϡ�
(1)̼���ơ�ˮ��������̼���Ի�������̼�����ơ�
(2)20�棬�������ơ�̼���ƺ�̼�����Ƶ��ܽ�����±���ʾ
���� | NaOH | Na2CO3 | NaHCO3 |
�ܽ��/g | 110 | 21.8 | 9.6 |
���ⶨ��ʵ�������װ��D���¶ȱ���20����
������̽����
(1)����a��������____________________��
(2)װ��B��ʢ�� NaHCO3��Һ��Ŀ��������װ��A�лӷ�����HCl���壬д��B�з�����Ӧ�Ļ�ѧ����ʽ��___________��
(3)װ��C��������________��ѡ��________(ѡ��E��F)�ﵽʵ��Ŀ�ģ�
(4)��ʵ�������װ��D�й۲쵽__________��˵��CO2��NaOH��Һ�ܷ�����Ӧ��
���������㡿
(5)װ��D��ʢ�е�210g20��NaOH������Һ�к���NaOH___________g��
(6)װ��D��NaOHȫ��ת����Na2CO3ʱ������������������Na2CO3_______________��?
(7)����װ��D��ͨ��������CO2ʱ�����Խ�NaOHȫ��ת��ΪNaHCO3��ʵ������л������� NaHCO3����________g(�����ǽᾧˮ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Сǿ�����һ����Ȥ��ʵ��(����ͼ��ʾ)�������ܳ�һ��ʱ������۲쵽С�Թ����о���������

(1)������Сǿ������������͵IJ������ݣ��������������Ľ���������д������Ũ���������ˮ�ԣ�_____________________________________________________��
(2)��ʵ��ǰ���¶Ȳ��䣬��ʵ�����������Һ��������������________(����������������������С����)ԭ�����������Һ�����������������������Һ�д��ڵ�����������____________(д���ӷ���)��
(3)Сǿ������ʵ����Ũ����ϡ�ͺ�������ȡ��������ԭ��ƿ����10 g 98%��Ũ���ᣬ��Ҫ����ϡ�ͳ�10%�����ᣬ��Ҫ����________gˮ��
(4)��ͼ�dz����Ļ�ѧʵ��������Сǿ����ȡˮʱ��Ӧѡ�����Ͳ������Ϊ________(����100������50��)mL�����⣬����Ҫ�����������________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�еĢ������Ƿ�Ԫ�ء���Ԫ����Ԫ�����ڱ��е���Ϣ��A.B.C.D���������ӵĽṹʾ��ͼ��

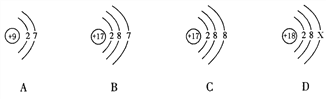
��ش�(1)��Ԫ�ص����ԭ������Ϊ__________����Ԫ�ص�ԭ������Ϊ____________��
(2)A.B.C.D����ͬ��Ԫ�ص�������_____________(����ĸ��ţ���ͬ)��
(3)A���ӵĻ�ѧ������B.C.D����һ�����ӵĻ�ѧ��������________.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����6�֣�
��1���������ʳ�ṹ���Ա������彡����
ij��ʳƷ�����ϱ�ǩ��ͼ��ʾ��

�ٸ������и��������ʵ������� ��
�ڴ�Ӫ������ĽǶȿ�����ʳƷ�г�ˮ�⣬��ȱ�ٵ�Ӫ������ ��
��2�����õ���̬����������������������
�����᳧����ˮ�к�����������ʣ����� �����кʹ��������ŷš�
���ڼ�ͥװ��ʱ��һЩ�����Ļ��ͷų�һ�ֶ������к����д̼�����ζ�����壬����������� ������ĸ����Ϊ�����������ڿ�������Ⱦ��Ӧע���ͨ�硣
A������ B��������̼ C����ȩ D������
��3���Ƚ��Ľ�ͨ���߿��üӿ���в�����
��2015��5��17�����й��ձ���������������·�ǹ����غ���·��ͨ������Ҫ��ɲ��֣�Ҳ��ʵʩ�����غ���������ս�Ե���Ҫ������ʩ��Ŀ��Ԥ��2017��5�µ��ɣ����ɺ��ձ��������������롰����ʱ�����������������ֲ��ϣ�
A���������� B���ϳɲ��� C�����ϲ���
����Ҫ��ѡ����գ�����ĸ����

���ֹ콨����Ҫ�����ĸ������������� ��
�����������ϳ��õ���ĥ����ʴ�ĵ��ڵȣ��������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������100g��Һ�����к�������ͭ����������������п���ֶԷ�Һ���д������õ�ͭ������п��Һ��ʵ����������ͼ��ʾ��
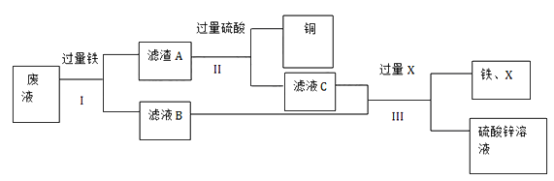
��1������I��II��III������IJ���������____��
��2����ҺB�е�������____________________�����ѧʽ��
��3�����۲쵽_________ʱ��˵������A�����Ѿ���ȫ��Ӧ��
��4������III�м����X��________�� ���ѧʽ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com