【答案】
分析:(1)根据物质的化学式,计算氧化铁的相对分子质量即式量;
(2)通过假设铁矿石的质量,利用反应的化学方程式中各物质的质量关系,由参加反应氧化铁的质量求得反应消耗一氧化碳的质量及生成二氧化碳的质量;由反应后排出的气体中一氧化碳的质量分数为10%,可计算出反应后气体中一氧化碳的质量,参加反应一氧化碳与剩余一氧化碳质量和即该炼铁过程中所用一氧化碳的质量;
(3)如果不除去杂质,反应后所得的产品中杂质的质量即所用铁矿石中杂质的质量,再由反应的化学方程式由氧化铁的质量求得所炼得铁质量,即可完成反应后所得的产品中杂质的质量分数.
解答:解:(1)Fe
2O
3的(式量)相对分子质量=56×2+16×3=160
(2)设赤铁矿石的质量为x
Fe
2O
3+3CO
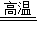
2Fe+3CO
2160 84 112 132
75%x
依题意得,反应后排出的气体中一氧化碳的质量为
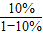
×
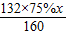
=
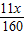
则炼铁过程中所用一氧化碳的总质量为
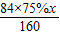
+
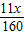
=
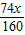
所以该炼铁过程中所用的原料赤铁矿石和一氧化碳的质量比为x:
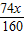
=80:37
(3)如果不除去杂质,反应后所得的产品中杂质的质量分数反应为
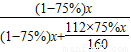
×100%=32.3%
解法二:
(2)设赤铁矿石的质量为160t,参加反应的CO的质量为x,生成的Fe的质量为y,CO
2的质量为z.
3CO+Fe
2O
3
2Fe+3CO
284 160 112 132
x 160t×75% y z
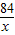
=
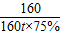
=
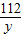
=
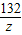
x=63t,y=84t,z=99t
依题意得,反应后排出的气体中一氧化碳的质量=99t×
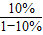
=11t
故炼铁过程中所用一氧化碳的总质量=63t+11t=74t
所以该炼铁过程中所用原料赤铁矿石和一氧化碳的质量比为160t:74t=80:37
(3)如果不除去杂质,反应后所得的产品中杂质的质量分数应为
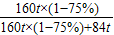
×100%=32.3%
答:(1)氧化铁的式量为160;
(2)该炼铁过程中所用原料赤铁矿石和一氧化碳的质量比为80:37;
(3)如果不除去杂质,反应后所得的产品中杂质的质量分数将会是32.3%.
点评:反应后的气体为一氧化碳和二氧化碳的混合气体,由混合气体中二氧化碳的质量计算出其中一氧化碳的质量是解答本问题的一个难点.

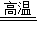 2Fe+3CO2
2Fe+3CO2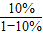 ×
×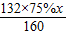 =
=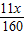
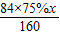 +
+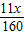 =
=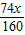
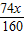 =80:37
=80:37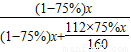 ×100%=32.3%
×100%=32.3% 2Fe+3CO2
2Fe+3CO2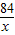 =
=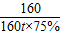 =
=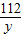 =
=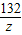
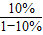 =11t
=11t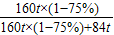 ×100%=32.3%
×100%=32.3%

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案