
【题目】钙被称为人体中的“钢筋混凝土”。
(人体中的钙)
(1)钢筋混凝土属于_____。
A 金属材料 B 合成材料 C 复合材料
(单质中的钙)
提出问题:钙的化合物很多,为什么我们很少提起单质钙呢?
思考猜想:钙的化学性质活泼。
实验验证一:
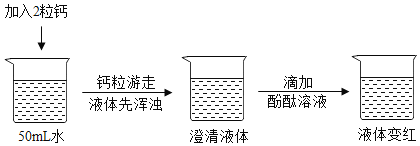
查阅资料:在一个化学反应中,有元素化合价升高,同时就有元素化合价降低。
(2)实验结论:①写出钙与水反应的化学方程式:_____。②该反应属于_____反应。(选填“吸热”或“放热”)
(干燥剂中的钙)
提出问题:一包生石灰干燥剂,使用一段时间后可能有哪些固体?
猜想假设:固体中含有氧化钙、氢氧化钙、碳酸钙。
(3)固体中除了氧化钙、氢氧化钙外,还可能会含有碳酸钙的依据是_____(用化学方程式表示)。
实验验证二:
(4)取固体样品加入水中,滴加酚酞后液体变红;继续加足量稀盐酸,如观察到_____,则固体含有碳酸钙。
(5)小明认为酚酞变红,则固体中一定还含有氢氧化钙。小红却对此提出质疑,其理由是:_____。
(6)为了进一步确定固体样品的成分,实验小组利用下图所示的装置(夹持仪器省略)进行实验。
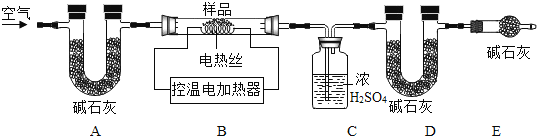
查阅资料:Ca(OH)2加热至580℃、CaCO3加热至825℃分别分解生成两种氧化物。
①实验前首先要连接仪器,检查装置的气密性,再装入样品。
②在B装置中放入155g固体样品,控温加热使装置B中反应完全,再通一段时间空气,测得反应前后装置C、D分别增重18.0g和22.0g,则固体样品中含有的物质为_____。
③装置E的作用_____。
(鸡蛋壳中的钙)
鸡蛋壳的主要成分是碳酸钙,工业上可以用鸡蛋壳制备钙的一种氧化物——“过氧化钙”,流程如下(假设各步骤均完全反应):
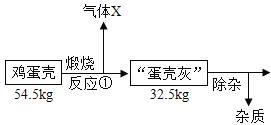

已知:鸡蛋壳中的杂质既不溶于水,也不参加反应;反应①是分解反应,反应②是化合反应,反应③是失去结晶水的分解反应。
(7)根据流程及相关数据,请求算出过氧化钙的化学式:_____(写出计算过程)。
【答案】C ![]() 放热
放热 ![]() 有气泡产生 CaO与水反应会生成Ca(OH)2,也会使无色酚酞变红 CaO、Ca(OH)2、CaCO3 吸收空气中的H2O和CO2,防止空气中的H2O和CO2进入装置D中,干扰实验测定 CaO2
有气泡产生 CaO与水反应会生成Ca(OH)2,也会使无色酚酞变红 CaO、Ca(OH)2、CaCO3 吸收空气中的H2O和CO2,防止空气中的H2O和CO2进入装置D中,干扰实验测定 CaO2
【解析】
(1)钢筋混凝土是由钢筋和粘土混合而成的,属于复合材料。故选C;
(2)①钙与水反应后,滴加无色酚酞试液,溶液变红,说明有碱性物质生成,根据质量守恒定律,化学反应前后,元素的种类不变,反应物为钙和水,故该碱性物质应为氢氧化钙,钙由游离态变为化合态,化合价升高,故应有元素化合价降低,反应还应生成了氢气,钙与水反应生成氢氧化钙和氢气,该反应的化学方程式为:![]() ;
;
②由图可知,一开始溶液浑浊,后溶液变得澄清,氢氧化钙微溶于水,且氢氧化钙的溶解度随温度的升高而降低,一开始溶液浑浊,后溶液变得澄清,说明该反应是放热反应,一开始反应放出热量,温度升高,氢氧化钙的溶解度降低,溶液浑浊,降温后,溶解度升高,溶液变得澄清,故填:放热;
猜想假设:
(3)氧化钙能与水反应生成氢氧化钙,氢氧化钙能与空气中的二氧化碳反应生成碳酸钙和水,该反应的化学方程式为:![]() ;
;
实验验证二:
(4)碳酸钙能与稀盐酸反应生成氯化钙、二氧化碳和水,故如观察到有气泡产生,说明固体中含碳酸钙,故填:有气泡产生;
(5)氧化钙能与水反应生成氢氧化钙,也能使无色酚酞试液变红,故不一定含氢氧化钙,故填:氧化钙与水反应生成氢氧化钙,也能使无色酚酞变红;
(6)②Ca(OH)2加热至580℃、CaCO3加热至825℃分别分解生成两种氧化物,根据质量守恒定律,化学反应前后,元素的种类不变,氢氧化钙中含钙、氢、氧三种元素,故生成的两种氧化物为氧化钙和水,碳酸钙含钙、碳、氧三种元素,故生成的两种氧化物为氧化钙和二氧化碳,装置C增重18.0g,应为氢氧化钙分解生成水的质量,装置D增重22.0g,应为碳酸钙分解生成二氧化碳的质量。
解:设该固体样品中氢氧化钙的质量为x
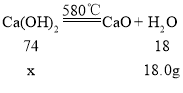
![]() x=74g
x=74g
解:设固体样品中碳酸钙的质量为y
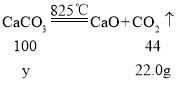
![]() y=50g
y=50g
74g+50g=124g<155g,故该固体样品中还含有氧化钙,氧化钙的质量为:155g-74g-50g=31g;
则固体样品中含有的物质为:碳酸钙、氢氧化钙、氧化钙;
③装置E中的碱石灰能吸收空气中的水蒸气和二氧化碳,防止其进入D装置,影响实验结果,故填:吸收空气中的H2O和CO2,防止空气中的H2O和CO2进入装置D中,干扰实验测定;
(7)鸡蛋壳的主要成分是碳酸钙,碳酸钙在高温的条件下分解生成氧化钙和二氧化碳,生成二氧化碳的质量为:54.5kg-32.5kg=22kg
设鸡蛋壳中碳酸钙的质量为z
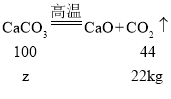
![]() z=50kg
z=50kg
 ,
,![]() ,氢氧化钙与过氧化氢反应生成过氧化钙,故碳酸钙中的钙元素都转化到了过氧化钙中,过氧化钙中钙元素的质量为:
,氢氧化钙与过氧化氢反应生成过氧化钙,故碳酸钙中的钙元素都转化到了过氧化钙中,过氧化钙中钙元素的质量为:![]() ,过氧化钙中氧元素的质量为:36kg-20kg=16kg,设过氧化钙的化学式为CamOn,40m:16n=20kg:16kg,m:n=1:2,故过氧化钙的化学式为:CaO2。
,过氧化钙中氧元素的质量为:36kg-20kg=16kg,设过氧化钙的化学式为CamOn,40m:16n=20kg:16kg,m:n=1:2,故过氧化钙的化学式为:CaO2。


科目:初中化学 来源: 题型:
【题目】马英同学取某地石灰石样品12g进行测定实验,现将100g稀盐酸分五次加入石灰石样品中(杂质不溶于水也不参与反应),充分反应后测得生成气体的总质量如表所示:
第1次 | 第2次 | 第3次 | 第4次 | 第5次 | |
加入稀盐酸的质量/g | 20 | 20 | 20 | 20 | 20 |
生成气体的总质量/g | 1.1 | 2.2 | m | 4.4 | 4.4 |
试求(反应的化学方程式:CaCO3+2HCl=CaCl2+H2O+CO2↑):
(1)m的值为 g。
(2)12g石灰石样品中碳酸钙的质量等于 g。
(3)反应完全后最终溶液中氯化钙的质量分数 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室现有锌、石灰石、高锰酸钾、稀硫酸、稀盐酸及下列仪器:
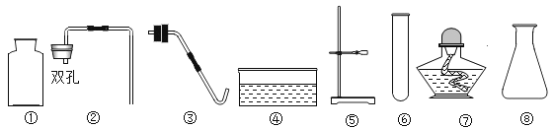
(1)仪器④的名称是_______;③中,把玻璃管插入带孔橡胶塞时,应先_______,然后对准橡胶塞上的孔稍稍用力转动,将其插入。
(2)若补充一种仪器_______(填名称),再利用上述仪器和药品一次性制取较多量的二氧化碳,应选择的仪器是_______(填序号),药品是_______。
(3)若利用棉花及上述仪器和药品制取氧气,应选择的仪器有_______(填序号),反应的化学方程式为_______。
(4)下图均为制取CO2的发生装置。其中,能“控制反应速率”的是_______(填序号,下同),能“控制反应发生和停止”的是_______。
a. 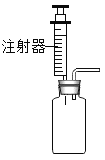 b.
b.  c.
c. 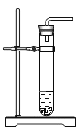 d.
d. 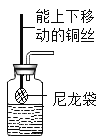
(5)利用上述药品还可制取H2,反应的化学方程式为_______;若用如图装置采用排空气法收集氢气,请在图中将导管补画完整________。
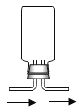
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】请结合图1回答问题:
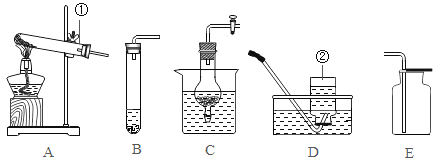
(1)仪器名称:①________________,②__________________。
(2)实验室用高锰酸钾制取并收集O2,可选用发生装置___________(选字母)和收集装置D组合,反应的化学方程式为________。
(3)实验室制取CO2的化学方程式为__________。用装置C相对于B的优点是______________;H2不可用装置E收集,理由是_______________。
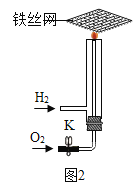
(4)氢氧焰实验:按图2所示装置进行实验
①关闭K,通入氢气,点燃(为何要先通氢气一会再点燃:________),将铁丝网放在火焰上灼烧,铁丝网只发红,不熔断。
②打开K,通入氧气,火焰更明亮,铁丝熔断,说明燃烧的剧烈程度与_________有关。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】NaCl是重要的资源,其应用与生产如下图所示。下列说法不正确的是
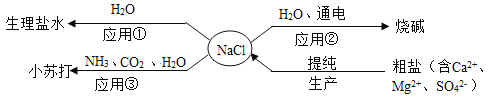
A.应用①操作的主要步骤为:计算、称量、溶解、装瓶、贴标签
B.应用②在制备烧碱的过程中,水参与了反应
C.应用③为提高产率应先通NH3,再通CO2,制备过程中还能得到一种化肥
D.生产中提纯粗盐时可依次加入过量的BaCl2、NaOH、Na2CO3溶液,再过滤、蒸发
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列设计方案可行,化学方程式书写及其反应类型都正确的是( )
A. 清洗试管壁上附着的铜:Cu+H2SO4=CuSO4+H2↑置换反应
B. 测定空气中氧气的含量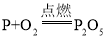 化合反应
化合反应
C. 用熟石灰处理硫酸厂的废水:Ca(OH)2 +H2SO4=CaSO4+2H2O复分解反应
D. 实验室制取二氧化碳: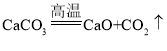 分解反应
分解反应
查看答案和解析>>
科目:初中化学 来源: 题型:
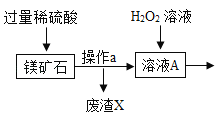
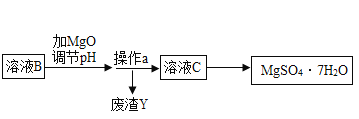
【题目】MgSO47H2O 是一种重要的化工原料,某工厂以一种镁矿石(主要成分为 SiO2和 MgCO3,还含有少量 FeCO3,其它成分忽略)为原料制备 MgSO47H2O 的主要流程如图:
查阅资料:①SiO2既不溶于水也不溶于稀硫酸。
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
阳离子 | Mg2+ | Fe2+ | Fe3+ |
开始沉淀时的 pH | 9.1 | 7.6 | 1.9 |
沉淀完全时的 pH | 11.1 | 9.7 | 3.2 |
请回答下列问题:
(1)MgCO3与稀硫酸发生反应的化学方程式为_________;为了让镁矿石与稀硫酸充分反应,提高原料利用率,可采取的措施为_____(填字母)。
A 将镁矿石粉碎 B 升高反应温度 C 用稀硫酸多次浸泡
(2)溶液 A中所含的溶质成分有_____;溶液 A中加入 H2O2溶液会生成 Fe2(SO4)3,该反应的化学方程式为_________。
(3)选用MgO调节pH使 Fe3+转化为沉淀,而不选用NaOH的原因是_____。加氧化镁调节后溶液的 pH范围是____ (用不等式表示)
(4)溶液C经加热浓缩、降温结晶、过滤、洗涤、低温干燥后得到 MgSO47H2O 晶体,低温干燥的目的是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】工业上利用表面含有油污且生锈的废铁屑制备硫酸亚铁晶体。
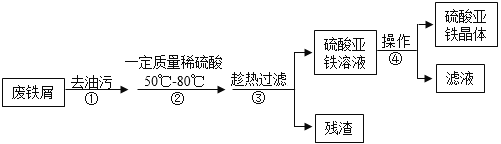
(1)下列能够去油污的试剂是__________(填字母)。
A水 B纯碱溶液 C明矾溶液 D稀硫酸
(2)步骤②中属于复分解反应的化学方程式是______________。控制“一定量稀硫酸”的目的是使铁过量,其原因是____________。
(3)步骤③要趁热过滤的原因是___________。
(4)步骤④的操作为___________、降温结晶、过滤、洗涤、干燥等。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图所示为实验室中常见的气体制备和收集装置。请回答下列问题:
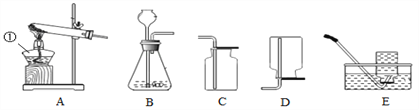
(1)写出图中标号仪器的名称:①_______________。
(2)用石灰石与稀盐酸反应制取CO2,反应的化学方程式为__________________,应该选用的发生装置是_______。可用C装置收集CO2气体的理由是___________,验满的方法是____________________。
(3)下图装置可用于气体的收集、检验、除杂和体积的测量等,用该装置能完成的实验是________(填字母)。
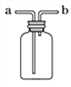
A.气体从b端通入,收集甲烷
B.瓶内装有澄清石灰水,气体从a端通入,检验氧气中是否混有二氧化碳
C.瓶内装有水,气体从a端通入,吸收氧气中混有的一氧化碳
D.在a端接量筒,瓶内装满水,氢气从b端通入,测量气体的体积
(4)实验室可用CO气体还原Fe3O4模拟工业炼铁。若冶炼50g含杂质4%的生铁,需要含Fe3O492.8%的磁铁矿石的质量是________?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com