
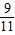 ═414m3 ;
═414m3 ;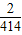 =
=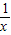 x=207m3 ;
x=207m3 ;

 小题狂做系列答案
小题狂做系列答案科目:初中化学 来源: 题型:
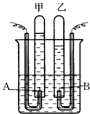 阿伏加德罗曾经总结出一条定律:在同温、同压下,同体积的任何气体都含有相同的分子数.如图是简易电解水的装置图,试根据观察到的实验现象回答下列问题:
阿伏加德罗曾经总结出一条定律:在同温、同压下,同体积的任何气体都含有相同的分子数.如图是简易电解水的装置图,试根据观察到的实验现象回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源:不详 题型:问答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com