
(1)汽车进入家庭已成为现代社会的普遍现象.
①制造汽车需要大量钢铁,以冶炼赤铁矿石为例,用化学方程式表示工业上炼铁的原理 .
②汽车表面喷漆可以延缓钢板锈蚀,其防锈原理是隔绝空气中的 和 .
③给汽车喷漆前需将铁制品放入稀盐酸中除锈(铁锈主要成分是Fe2O3).其反应的化学方程式是 .
(2)向装有等量水的A、B、C烧杯中分别加入10g、25g、25gNaNO3固体,充分溶解后,现象如图1所示.
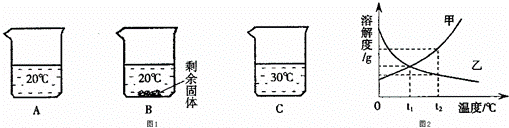
①烧杯中的溶液一定属于饱和溶液的是 (填字母序号,下同)
②图2能表示NaNO3溶解度曲线的是 (填“甲”或“乙”);
③由图2分析,若分别将100g甲、乙的饱和溶液从t2℃降温到t1℃,对所得溶液的叙述正确的 (填序号).
A.甲、乙都是饱和溶液 B.溶液质量:甲>乙 C.溶质质量分数:甲>乙.
| (1)①根据一氧化碳和氧化铁反应生成铁和二氧化碳进行解答; ②根据铁生锈的条件是与空气中氧气和水同时接触进行解答; ③根据稀盐酸和氧化铁反应生成氯化铁和水进行解答; (2)①根据一定温度下,有剩余固体存在的溶液为饱和溶液进行解答; ②由烧杯中不同温度下溶解的硝酸钠的质量变化分析解答; ③根据甲乙的溶解度曲线随温度变化情况,并结合选项中的问题逐一分析解答. | |
| 解答: | 解:(1)①一氧化碳和氧化铁反应生成铁和二氧化碳,化学方程式为3CO+Fe2O3 ②铁生锈的条件是与空气中氧气和水同时接触,所以汽车表面喷漆可以延缓钢板锈蚀,其防锈原理是隔绝空气中的氧气和水; ③稀盐酸和氧化铁反应生成氯化铁和水,化学方程式为Fe2O3+6 HCl=2FeCl3+3H2O; (2)①由图1可知:20℃时向A烧杯中加入10g完全溶解,可能是饱和溶液;B烧杯中加入25g有剩余固体,一定属于饱和溶液;30℃加入25g全部溶解,可能是饱和溶液; ②由图1可知,随着温度的升高溶解的硝酸钠的质量逐渐增加,所以在图2中,能表示NaNO3溶解度曲线的是甲; ③A、乙的溶解度随温度降低逐渐增大,故降低温度变为不饱和溶液,故A错误; B、分别将100g甲、乙的饱和溶液从 t2℃降温到 t1℃,甲有溶质析出,溶液的质量甲<乙,故B错误; C、等质量的甲、乙饱和溶液从 t2℃降温至 t1℃时,甲析出溶质,乙由于溶解度增大而无晶体析出.降低到 t1℃时,溶解度是甲=乙,但由于乙不是饱和溶液,所以其溶质的质量分数是甲>乙,故C正确. 故答案为:(1)①3CO+Fe2O3 (2)①B;②甲; ③C. |


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:初中化学 来源: 题型:
| ||
| ||

查看答案和解析>>
科目:初中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
物质的用途与其性质密切相关。
(1)汽车进入家庭已成为现代社会的普遍现象。
①汽车表面喷漆,可以延缓汽车的锈蚀,其防锈原理是隔绝空气中的 。
②制造汽车需要大量钢铁,工业上炼铁的原理是 。(用化学方程式表示)
③喷漆前需将铁制品放入稀盐酸中除锈(铁锈主要成分是Fe2O3),反应初期可观察到溶液由无色变为 ,这是因为 (填化学方程式)的缘故;反应进行一会儿,又可以观察到有无色气泡产生,该反应的化学方程式是 。
(2)铝、铁、铜是人类广泛使用的三种金属,与我们生活息息相关。分别用下列一种试剂就能直接验证这三种金属的活动性顺序的是 (填字母序号)。
A.硫酸铝溶液 B.硫酸亚铁溶液 C.硫酸铜溶液 D.稀硫酸
(3)在AgNO3和Cu(NO3)2的混合溶液中,加入一定量的铁粉充分反应,过滤后得到滤液和滤渣;向滤渣中加入足量的稀盐酸,无明显现象。则滤液中一定含有的溶质是 ;可能含有的溶质是 。
查看答案和解析>>
科目:初中化学 来源:北京市模拟题 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com