【答案】
分析:(1)①、③根据书写化学方程式的步骤:写、配、注、等,正确书写化学方程式;
②考查质量守恒定律解释化学变化中质量的增加原因;根据铁生锈是铁与空气中氧气、水反应,参加反应铁、水、氧气的质量总和等于生成铁锈的质量,进行判断;
(2)考查金属与盐溶液反应的条件.由于反应后滤出固体中滴入稀硫酸无气泡产生,可判断铁粉不足或恰好反应,则滤出固体中一定有Ag(由于在金属活动中Ag活泼性最弱),滤液中一定含有Fe(NO
3)
2和Zn(NO
3)
2,进行解答;
(3)依据反应后的质量减少是生成氢气质量,再依据金属与稀硫酸反应条件知,产生的氢气是由锌与稀硫酸反应而铜不反应.
解答:解:(1)①一氧化碳和磁铁矿冶炼金属铁的化学方程式为:Fe
3O
4+4CO

3Fe+4CO
2 ;
②由于铁生锈是铁与空气中氧气、水反应,参加反应铁、水、氧气的质量总和等于生成铁锈的质量,所以铁锈蚀后的质量增加.所以不遵守质量守恒定律的结论不正确;
③稀盐酸除铁锈反应的化学方程式为:Fe
2O
3+6HCl═3H
2O+2FeCl
3;
(2)由于反应后滤出固体中滴入稀硫酸无气泡产生,可判断铁粉不足或恰好反应,则滤出固体中一定有Ag(由于在金属活动中Ag活泼性最弱),滤液中一定含有Fe(NO
3)
2和Zn(NO
3)
2,滤液中一定含有的金属离子为Fe
2+和 Zn
2+;
反应的化学方程式为:Fe+Cu(NO
3)
2═Fe(NO
3)
2+Cu 或 Fe+2AgNO
3═Fe(NO
3)
2+2Ag;
(3)依题知生成氢气的质量=10g+100g-109.8g=0.2g;设铜锌合金中锌的质量为x,稀硫酸中溶质的质量为y
Zn+H
2SO
4═ZnSO
4 +H
2↑
65 98 2
x y 0.2g

=
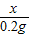
x=6.5 g

=

y=9.8 g
铜锌合金中铜的质量分数为

×100%=35%;
稀硫酸中溶质的质量分数为

×100%=9.8%;
答:①铜锌合金中铜的质量分数为35%;
②稀硫酸中溶质的质量分数为9.8%.
故答案为:
(1)①Fe
3O
4+4CO

3Fe+4CO
2 ;
②不正确,由于铁生锈是铁与空气中氧气、水反应,参加反应铁、水、氧气的质量总和等于生成铁锈的质量,所以铁锈蚀后的质量增加;
③Fe
2O
3+6HCl═3H
2O+2FeCl
3;
(2)Ag; Fe
2+和Zn
2+; Fe+Cu(NO
3)
2═Fe(NO
3)
2+Cu 或Fe+2AgNO
3═Fe(NO
3)
2+2Ag
(3)依据反应后的质量减少是生成氢气质量,再依据金属与稀硫酸反应条件知,产生的氢气是由锌与稀硫酸反应而铜不反应.
依题知生成氢气的质量=10g+100g-109.8g=0.2g;设铜锌合金中锌的质量为x,稀硫酸中溶质的质量为y
Zn+H
2SO
4═ZnSO
4 +H
2↑
65 98 2
x y 0.2g
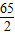
=
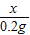
x=6.5 g

=

y=9.8 g
铜锌合金中铜的质量分数为

×100%=35%;
稀硫酸中溶质的质量分数为

×100%=9.8%;
答:①铜锌合金中铜的质量分数为35%;
②稀硫酸中溶质的质量分数为9.8%.
点评:本题考查学生对金属活动性顺序的理解与应用,根据化学方程式进行计算的解题能力;
注意:金属铁在与酸、盐溶液的置换反应中,只能生成+2价的亚铁盐,而不是+3价的铁盐.

 3Fe+4CO2 ;
3Fe+4CO2 ; =
=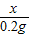 x=6.5 g
x=6.5 g =
= y=9.8 g
y=9.8 g ×100%=35%;
×100%=35%;  ×100%=9.8%;
×100%=9.8%; 3Fe+4CO2 ;
3Fe+4CO2 ;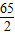 =
=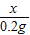 x=6.5 g
x=6.5 g =
= y=9.8 g
y=9.8 g ×100%=35%;
×100%=35%;  ×100%=9.8%;
×100%=9.8%;



 金属是一类重要的材料,人类的生活和生产都离不开金属.
金属是一类重要的材料,人类的生活和生产都离不开金属.